全球首例!除了心、肝、腎,豬的這個器官也成功移植給人
等一顆救命的器官需要多久?在醫學探索的浩瀚征程中,器官移植一直是挽救生命、對抗絕症的終極手段之一。然而,全球器官供體嚴重短缺,無數患者沒能等到匹配的器官就遺憾離世。爲了填補這個缺口,科學家們將目光投向了異種器官移植(xenotransplantation),即將動物器官移植入人體。其中,豬,因其器官大小和功能與人體相似、繁殖快、倫理爭議較少且病原體風險可控,被認爲是最理想的異種移植供體動物。
2025年8月,廣州醫科大學第一附屬醫院的科研團隊在《自然-醫學》上發表的一份研究,報道了世界首例將豬肺成功移植到一名腦死亡男子體內的案例,並詳細記錄了器官持續通氣與氣體交換長達九天的過程。這一成果是對最複雜器官之一——肺臟——進行跨物種移植可行性的有力證明。
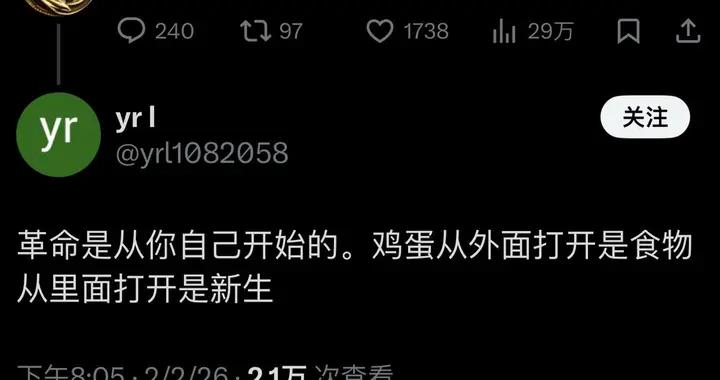
豬-人異種器官移植示例
(圖源:參考文獻1)
首例成功之後:豬肺在人體內經歷了什麼?
想要讓豬肺在人體內順利“工作”,首先就要對它進行“改造”研究團隊使用基因編輯技術修改供體豬肺,旨在降低異種器官被人體免疫系統識別爲“外來物”的風險,減少免疫排斥和炎症反應。手術中,醫生將患者左肺切除,接上了豬肺。冷缺血時間——也就是器官被取出後到重新復灌的間隔——長達206分鐘,這對於肺而言是巨大的考驗。
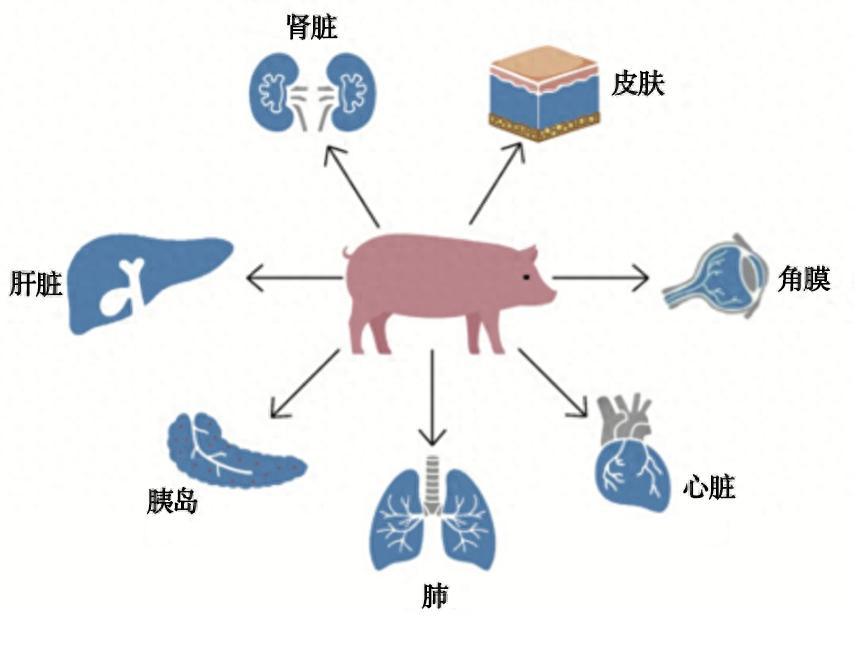
豬肺-人異種器官移植實驗流程示意圖,包含免疫抑制方案。在時間軸上方的示意圖中,取自基因編輯供體豬(GTKO/B4GalNT2KO/CMAHKO/CD55/CD46/TBM)的左肺被異種移植到腦死亡受體體內,隨後從吻合後的左肺動脈(LPA)和左肺靜脈(LPV)進行肺活檢與血氣採樣。
(圖源:參考文獻2)
術後,醫護團隊開始嚴密監護。術後前幾個小時,豬肺在灌注血液後能夠正常膨脹、通氣,血氣指標顯示它在順利完成氧氣與二氧化碳的交換。兩小時活檢的組織切片也幾乎正常,超急性排異並未發生。然而挑戰很快到來:
術後24小時,影像學顯示移植物開始瀰漫性水腫,背部出現大片實變,組織切片中可見巨噬細胞浸潤。這與人類肺移植常見的“原發移植物功能障礙”(PGD)相似,通常源自缺血再灌注損傷——器官在脫離供體後再接入血液循環時,一時難以適應受到的衝擊。
第三天,免疫系統的反應顯現。組織切片顯示抗體沉積在肺泡間隔,補體分子C4d沿着血管內皮分佈——這是典型的抗體介導性排異。
第六天,損傷進一步加劇。但令人意外的是,到第九天,部分指標反而出現恢復跡象——水腫略有減輕,肺順應性有所回升。因家屬提出要求,實驗最終終止。
這九天的數據如同一部緊張的電影,展示了異種器官在人體環境中複雜而動態的命運。雖然移植肺已經歷一場免疫風暴,但在藥物與機體複雜交互下,它並未完全衰竭。
爲了防止免疫排斥,研究團隊採用了複雜的免疫抑制方案,其中包括多種藥物協同作用,力圖在保護移植器官的同時,減少對人體其他生理功能的傷害。
值得指出的是,相比於異種心臟、腎臟和肝臟的移植,肺臟移植被公認爲面臨着大得多的挑戰。肺臟的獨特性質使其在生理和免疫學上都更加脆弱和複雜。
人體肺臟
(圖片來源:Live Science)
首先,肺臟的生理平衡極爲微妙。它既是氣體交換的場所,又要接受大量的血流灌注。這種雙重功能使其在移植過程中,特別是在恢復血流後,極易受到缺血再灌注損傷。
更具挑戰性的是,肺臟是唯一一個持續暴露在外界空氣中的內臟器官,時刻接觸着空氣中的病原體和污染物,這就要求其擁有一個高度活躍和複雜的免疫防禦系統。然而,正是這種“超反應”的免疫防禦機制,使得移植後的異種肺臟更容易遭受人體免疫系統的猛烈攻擊,發生排斥反應。
豬器官想要安全移植人體,要闖三道“生死關”
第一關:免疫排斥——人體攻擊外來器官
豬器官異種移植中,免疫排斥始終是最核心障礙。移植後數分鐘之內,人體免疫系統這個“安保系統”就會迅速識別豬器官上的異種抗原,引發以下排斥反應:
超急性排斥(HAR,hyperacute rejection):受體血液中預存的抗豬抗體識別移植物血管內皮細胞抗原並激活補體,導致炎症、間質出血、內皮損傷、血栓形成和缺血,從而快速破壞移植物。
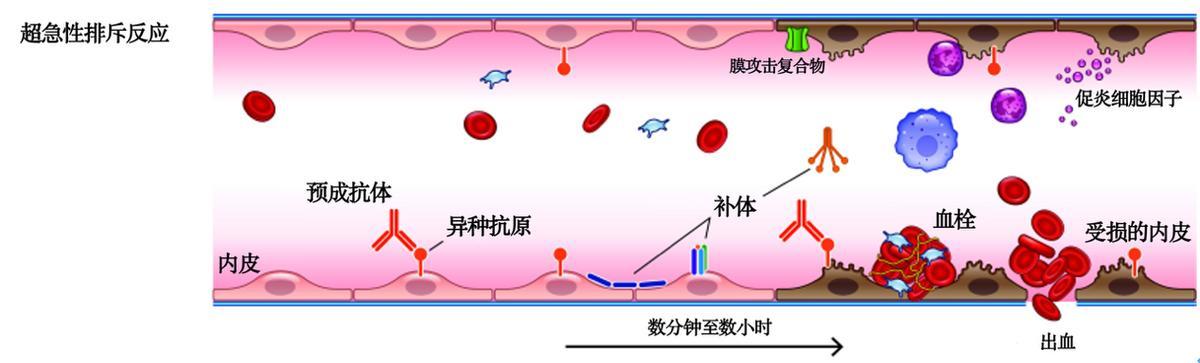
超急性排斥(HAR)
(圖片來源:參考文獻3)
隨後,可能發生延遲性排斥(DXR,delayed xenograft rejection),表現爲免疫細胞大量浸潤,產生新抗體和細胞因子。豬MHC I類分子[豬白細胞抗原(SLA I)]與靈長類NK細胞抑制性受體結合不足,導致NK細胞介導的細胞毒作用;豬CD47不足以抑制靈長類SIRP-α,容易受到巨噬細胞吞噬。
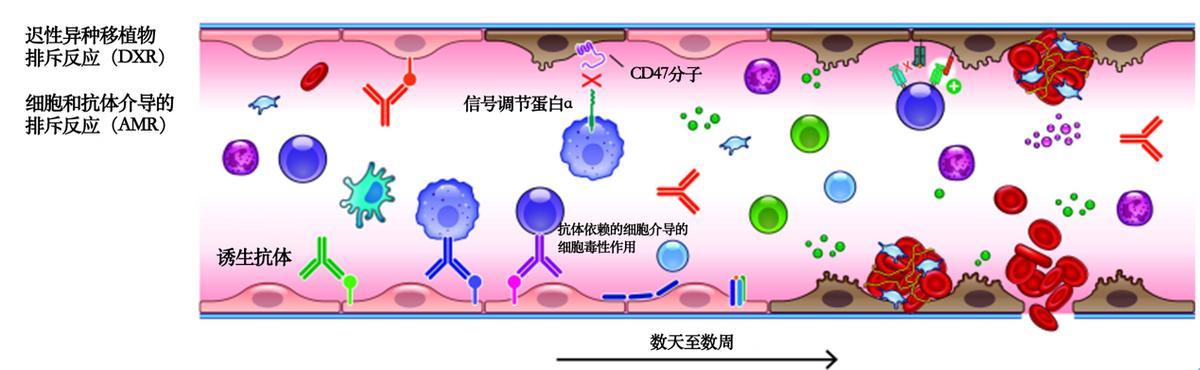
延遲性排斥(DXR)
(圖片來源:參考文獻3)
長期移植中,還可能出現慢性排斥(chronic rejection)。反覆的抗體和細胞介導排斥引起血管內皮病變、血管狹窄和間質纖維化,逐漸削弱器官功能。同時,T細胞通過TCR識別抗原並在共刺激信號作用下被激活,B細胞在抗原呈遞和CD40/CD40L相互作用下產生抗體,進一步參與排斥反應。
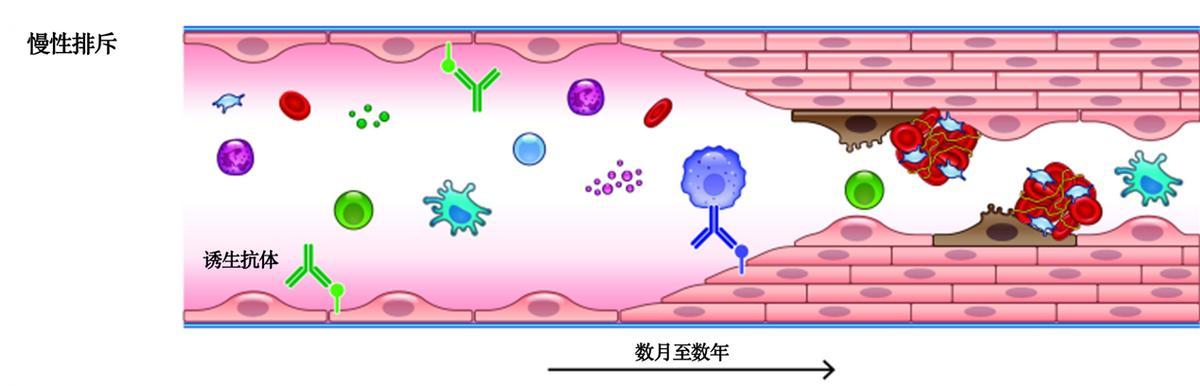
慢性排斥
(圖源:參考文獻3)
第二關:凝血紊亂引發血栓
除此之外,豬和人類器官在生理功能上的不兼容性也是一個重要障礙。其中,凝血系統的差異尤爲突出。豬器官的血管內皮細胞可能從抗凝狀態轉變爲促凝狀態,引發血栓微血管病變,導致器官血栓形成和功能衰竭。
第三關:跨物種病毒傳播
跨物種病毒傳播是異種器官移植的第三個不容忽視的挑戰,這是關乎公共衛生的生物安全問題。動物(特別是豬)身上可能攜帶多種對自身無害、但可能跨物種傳播並感染人類的病原體,比如豬內源性逆轉錄病毒(PERV)和豬鉅細胞病毒(PCMV)。如果這些病毒通過器官移植進入人體,很可能引發新的疾病問題,因此必須嚴防風險。
基因編輯讓豬器官“改頭換面”
要闖過以上三道“生死關”,關鍵在於對豬器官的基因編輯改造。科學家主要利用兩種方式——“敲除”和“敲入”。
首先是“敲除”豬的內源性基因,旨在移除那些最容易引發排斥反應的“豬特徵”。其中最重要的便是 GGTA1 基因,該基因負責合成α-半乳糖,去掉它就可以從根本上消除這種抗原,從而避免最劇烈的超急性排斥反應。此外,B4GALNT2 和 CMAH 等基因也會被敲除,以去除其他可能引發延遲排斥的其他抗原。爲了應對生理不兼容性,例如防止器官在人體內過度生長,研究人員還會敲除控制器官大小的基因。爲了避免豬病毒傳人,一些公司在製備豬隻時敲除了豬基因組中與PERV相關的基因序列,同時在高度生物安全的隔離設施中飼養豬隻,以確保其“特定病原體無菌”,降低病毒傳播風險。
其次是“敲入”人類的保護性基因,旨在賦予豬器官在人體內自我保護的能力,使其更具“人類”特徵。這些基因通常編碼人類自身的補體調節蛋白和凝血調節蛋白,具有自我保護的能力。例如,敲入hCD46、hCD55和hCD59 等基因,可以保護移植器官免受人類補體系統的攻擊。而敲入hTBM(人類血栓調節蛋白)等基因,則有助於解決豬和人類凝血系統之間的不相容問題,防止移植器官內出現血栓形成。
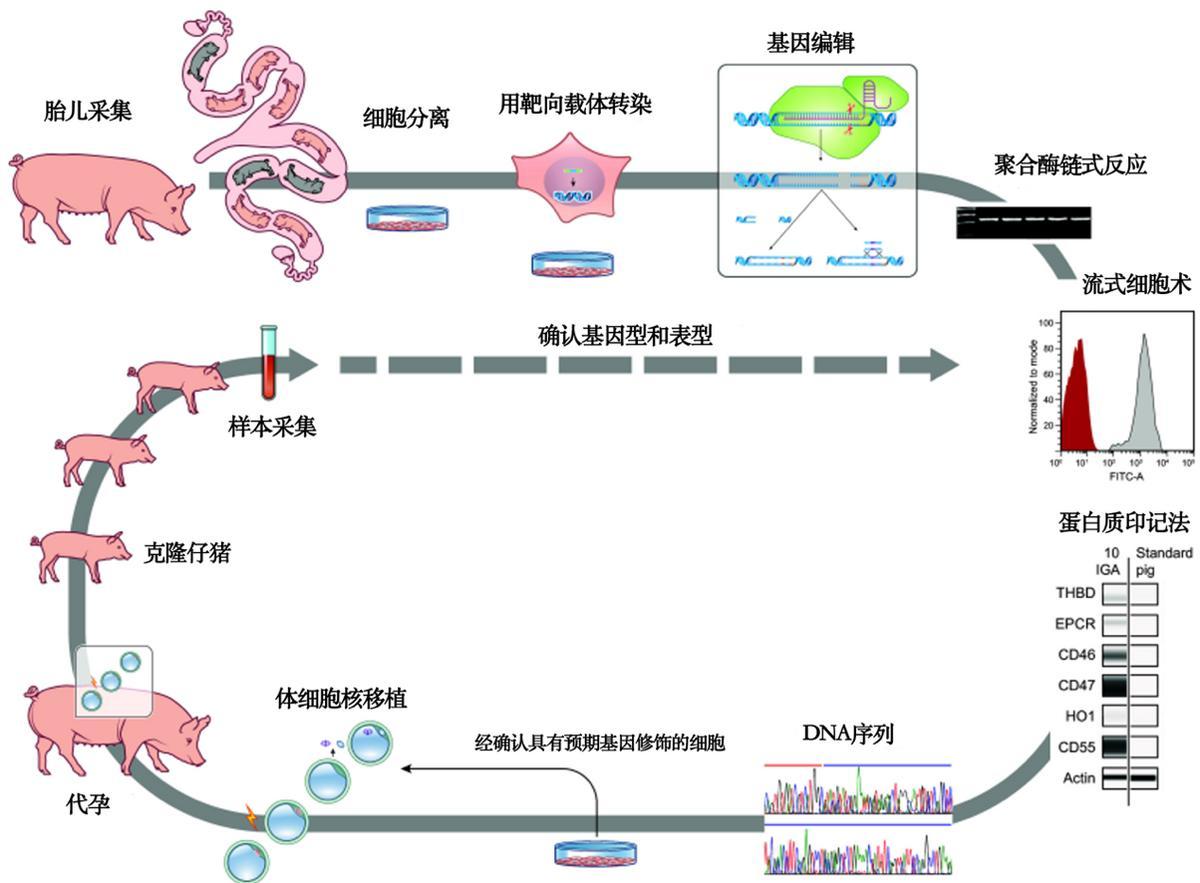
基因編輯豬的製備流程:從中期胎兒中分離成纖維細胞,培養後轉入基因打靶載體進行編輯。通過PCR和DNA測序篩選基因型,並結合Western blot和流式細胞術檢測蛋白表達或缺失。獲得目標基因型和表型的細胞用於體細胞核移植(SCNT),生成克隆豬仔。經基因型和表型確認的豬仔可再次提供細胞用於後續多輪基因工程改造。
(圖源:參考文獻3)
這種“雙向”基因編輯策略,讓豬器官既“不那麼像豬”,反而更像人類。但是,即使供體豬經過了精心的基因編輯,仍需要強大的免疫抑制方案來管理後續的免疫反應。
傳統的免疫抑制方案通常包括鈣調磷酸酶抑制劑(如他克莫司、環孢素)、抗增殖藥物(如嗎替麥考酚酯)和糖皮質激素。這些藥物通過抑制T細胞和B細胞的活性,來防止細胞介導的排斥反應。在豬肺移植案例中,研究團隊就使用了包括抗胸腺細胞球蛋白、利妥昔單抗、依庫珠單抗等在內的複雜藥物組合。
然而,這些廣譜的免疫抑制劑如果長期、大劑量使用,會顯著增加受體感染、心血管疾病的風險。因此,醫學界正探索更具靶向性和更安全的免疫抑制策略。一種前沿的嘗試是使用新型生物製劑,如研究性藥物 tegoprubart——一種抗CD40L抗體。CD40L信號通路是移植排斥的核心機制。通過阻斷這一通路,該藥物能夠有針對性地抑制 T 細胞和 B 細胞的激活,同時,它還能在一定程度上增強能夠抑制免疫反應的調節性 T 細胞(Tregs)的活性。
當然,就生物安全來說,儘管採取了預防措施,但仍無法完全排除未知跨物種病毒傳播的可能性。正如首例豬心移植患者的案例,這風險是真實存在的。
豬——人異種器官移植的先行者
不止是肺,豬的心臟、腎臟和肝臟早已開始了“跨界”實驗。肺臟移植的成功是建立在其他主要器官移植研究多年積累的經驗之上。
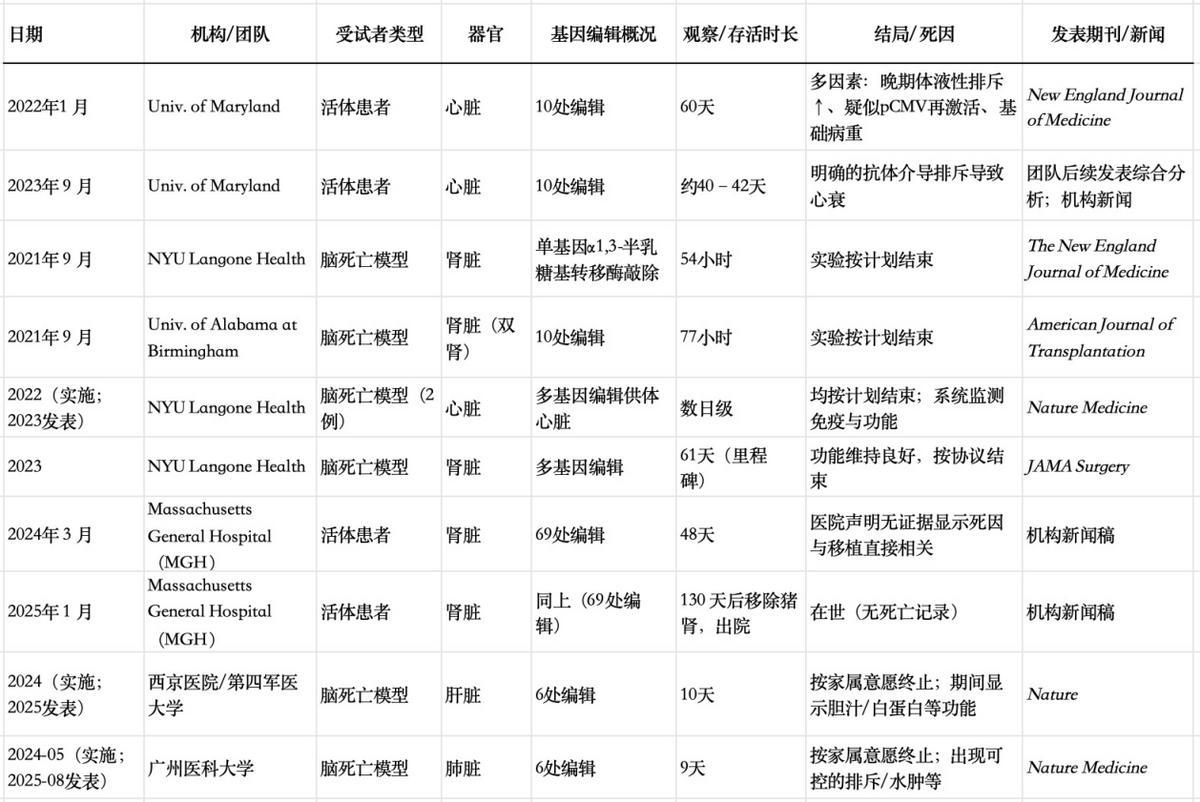
豬-人異種器官移植主要臨牀案例
(來源:作者整理)
豬心移植
2022年1月,全球首例基因編輯豬心臟移植手術於在美國馬里蘭大學醫學中心完成,接受移植的患者戴維·貝內特生存了約兩個月。他的案例證明了豬心臟在人體內的短期功能可行性,然而不幸的是,他最終因感染了源自供體豬的病毒而離世。
吸取了這一教訓,2023年9月,馬里蘭大學醫學中心進行了第二例豬心移植手術。患者勞倫斯·福塞特移植了一顆經過十處基因編輯的豬心臟,其中包括敲除了三個可能引發排斥反應的豬基因和一個控制器官大小的基因,同時敲入了六個人類基因以增強兼容性。這顆心臟在手術後的第一個月表現良好,但患者最終在約40天后因出現排異跡象而死亡。
豬腎移植
2024年3月,全球首例活體人類接受基因編輯豬腎臟移植手術在美國馬薩諸塞州總醫院完成,患者是62歲的理查德·斯萊曼。儘管斯萊曼在術後近兩個月後去世,但院方表示,沒有任何跡象表明他的死亡是由移植引起的。
隨後,紐約大學朗格尼健康中心在2024年12月完成了又一例活體豬腎移植,患者託瓦娜·魯尼順利出院,併成爲首例存活超過兩個月的豬腎移植患者。魯尼的手術醫生是紐約大學朗格尼移植研究所所長羅伯特·蒙哥馬利,這位醫生本人也曾於2018年接受人心臟移植手術。
豬肝移植
2024年,中國第四軍醫大學西京醫院團隊的研究人員在腦死亡人體模型中完成了全球首次基因編輯豬肝臟移植。經過六個基因編輯的豬肝臟被移植到了一位腦死亡的患者體內,該實驗持續了10天,最終應家屬要求而終止。
在實驗期間,移植的豬肝臟展示了良好的基本代謝功能,包括能夠產生白蛋白和膽汁,並且沒有出現其他異種移植模型中常見的嚴重凝血功能障礙。此外,肝臟保持了穩定的血流,並且沒有出現超急性排斥反應或任何急性排斥的跡象。
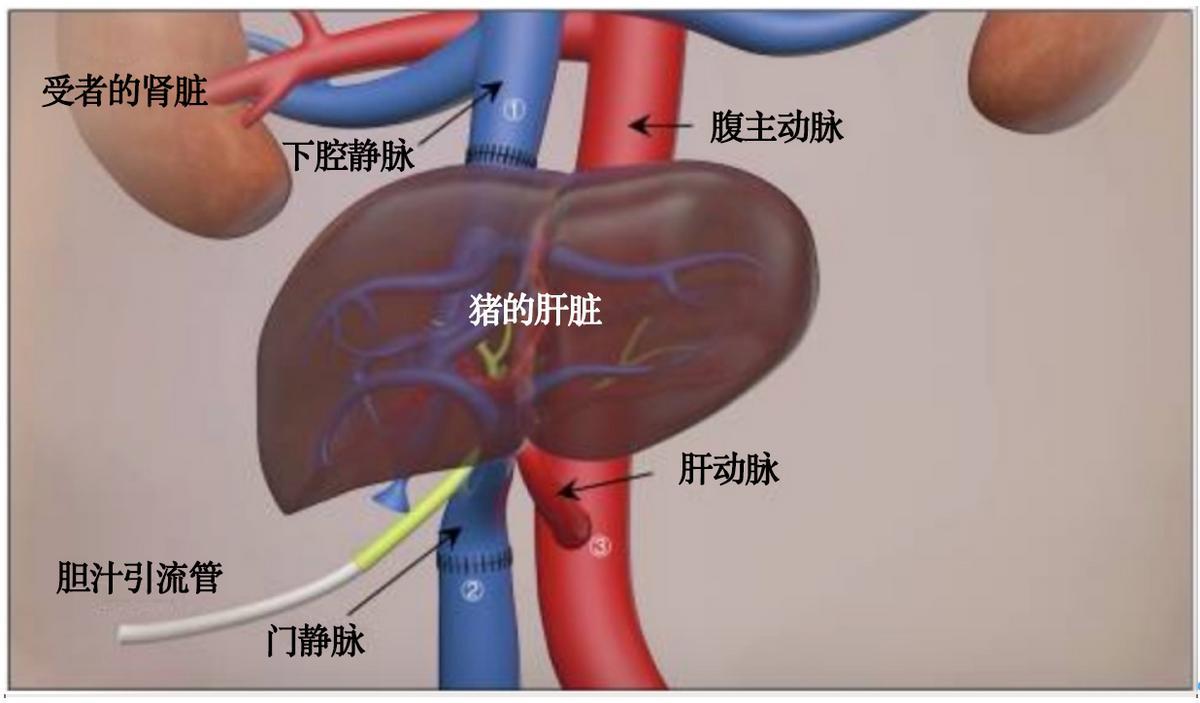
豬肝-人器官移植手術示意圖。
(圖源:參考文獻6)
技術之外,還有兩道“軟門禁”
值得注意的是,這些早期的移植手術是在“同情使用”計劃下進行的,而非正式的臨牀試驗。不可否認的是,豬-人異種器官移植的未來已來。目前,美國食品藥品監督管理局(FDA)已正式批准了豬腎人體移植臨牀試驗。大規模的正式臨牀試驗或於未來幾年啓動,初期大概率聚焦成人腎移植與兒童心臟移植。但在其應用之前,還有三道關鍵關卡待突破。
首先是技術層面,需進一步攻克免疫排斥等技術難題,讓豬器官在人體內實現長期穩定工作,目前移植器官的存活時長也仍需大幅提升。
其次是倫理規範的明確。動物福利、“救人”與“護動物”的平衡、患者知情同意的邊界、病毒風險的防控標準等,都需要政府監管、科學界與社會各界共同商議探討,形成統一準則。
最後是公衆信任建立。文化、宗教都會影響個人對豬器官的接受程度。有調查顯示,多數人對這項技術持謹慎支持態度,但當了解到器官效果可能不及人類器官、存在病毒風險時,支持率會明顯下降。公衆的接受度和信任將也是異種移植最終能否融入主流醫療體系的關鍵。
“跨界”器官移植的未來,不僅於“活下去”
現代醫學正在拓展人類生命的邊界。“借來之心”、“異類之腎”的跳動和運作,證明了科學能夠把不可思議化爲現實。
但這條路還很長。免疫排斥、跨種病毒、長期存活的不確定性仍舊是不易攻克的難題,倫理與價值的拷問是更深層的困境。
“人類生命至上”似乎是一直是默認的準則,但在拯救人類生命的同時,如何科學且負責地處理跨物種移植所涉及的倫理與生物風險,還需要未來研究在技術優化、免疫管理和倫理監管之間保持平衡,提出更系統的評估框架。異種移植或許不僅僅是一場醫學實驗,同時也試煉着人類文明與價值選擇。
參考文獻:
- Niu D, Ma X, Yuan T, et al. Porcine genome engineering for xenotransplantation. Adv Drug Deliv Rev. 2021;168:229-245. doi:10.1016/j.addr.2020.04.001
- He J, Shi J, Yang C, et al. Pig-to-human lung xenotransplantation into a brain-dead recipient. Nat Med. Published online August 25, 2025. doi:10.1038/s41591-025-03861-x.
- Peterson L, Yacoub MH, Ayares D, et al. Physiological basis for xenotransplantation from genetically modified pigs to humans. Physiol Rev. 2024 Jul 1;104(3):1409-1459. doi:10.1152/physrev.00041.2023. Epub 2024 Mar 22. PMID: 38517040.
- Montgomery RA, Stern JM, Lonze BE, et al. Results of Two Cases of Pig-to-Human Kidney Xenotransplantation. N Engl J Med. 2022 May 19;386(20):1889-1898. doi:10.1056/NEJMoa2120238. PMID: 35584156.
- Moazami N, Stern JM, Khalil K, et al. Pig-to-human heart xenotransplantation in two recently deceased human recipients. Nat Med. 2023 Aug;29(8):1989-1997. doi:10.1038/s41591-023-02471-9. Epub 2023 Jul 24. PMID: 37488288.
- Tao KS, Yang ZX, Zhang X, et al. Gene-modified pig-to-human liver xenotransplantation. Nature. 2025 May;641(8064):1029-1036. doi:10.1038/s41586-025-08799-1. Epub 2025 Mar 26. PMID: 40140580.
- Rodger D, Hurst DJ, Cooper DK. Xenotransplantation: A historical-ethical account of viewpoints. Xenotransplantation. 2023 Mar;30(2):e12797. doi:10.1111/xen.12797. Epub 2023 Mar 21. PMID: 36943143.
- The Medical Miracle of a Pig’s Heart in a Human Body. By Rivka Galchen,THE NEW YORKER, February 21, 2022
出品:科普中國
作者:李娟(生命科學專業博士)
監製:中國科普博覽