天選蘭花的生存智慧:成功需要努力配點運氣
三枚萼片、三枚花瓣、一個合蕊柱,這樣獨特的外貌讓我們可以很容易辨認出蘭科植物。蘭科植物種類豐富,當前確認的約有815屬22000-27000餘種。它們的花瓣千姿百態,有袋狀的兜蘭(Paphiopedilum spp.)、瓣狀的文心蘭(Oncidium flexuosum)、分葉狀的鶴頂蘭(Phaius tancarvilleae)、絲狀的章魚蘭(Prosthechea cochleata)等超過數十種類型,顏色也極爲豐富,幾乎涵蓋了可見光譜中的所有顏色,如紅色系火焰蘭(Renanthera coccinea)、紫色系紫紋兜蘭(Paphiopedilum purpuratum)、白色系夜夫人白拉索蘭(Brassavola nodosa)等等;身材魁梧如身高最高可達7米的皇后蘭(Grammatophyllum speciosum),嬌小柔弱如花序僅有1-2cm的小沼蘭(Oberonioides microtatantha)。蘭科植物的每個形態、每種特點都不是隨便長長,而是爲了生存、繁衍、適應環境,千錘萬鑿雕刻出來的自然藝術品。

圖片說明:1.文心蘭2.鶴頂蘭3.章魚蘭4.火焰蘭
5.紫紋兜蘭6.夜夫人白拉索蘭7.皇后蘭8.小沼蘭
(圖片來源:李光敏、劉冰、吳棣飛、華國軍、
金寧、葉喜陽;NParks Flora & Fauna Web;製圖:李彤)
一、努力+運氣=增加被自然選擇的概率
約6500萬年前,一顆直徑10公里的小行星以每秒20公里的速度撞擊地球,引發了海嘯、全球性火山爆發、食物鏈斷裂和持續數年的“核冬天”,稱霸地球1.6億年的恐龍就此滅絕,在這場“末日篩選”中,僅有約25%的物種幸運地被自然選擇存活下來,成爲“新生代地球”的新主人,其中就有蘭科植物的祖先。
成功很大程度上取決於是否被環境選擇,身上的技能越多,被選擇的概率就越大。碰巧在白堊紀末大滅絕前經歷了一次全基因組複製(WGD)事件的蘭科植物祖先,將自己的遺傳密碼完整複製了一份,並在較短的時間內分化出即可陸生,又可附生,還可腐生的五個亞科—擬蘭亞科(2屬17種)、香莢蘭亞科(15屬種)、杓蘭亞科(5屬種)、樹蘭亞科(500多屬24000種)和蘭亞科(208屬3630種)(數據截至2019年),這些植物能夠在不同的氣溫、溫度與光照條件下存活,如此強大的環境適應性不僅讓蘭科植物從滅絕邊緣倖存,還讓它們迅速佔據了因大滅絕造成的空缺生態位,逆襲成爲可以在地球上大部分棲息地定居的居民,發展成當今被子植物中種類最豐富且形態高度特化的類羣之一。
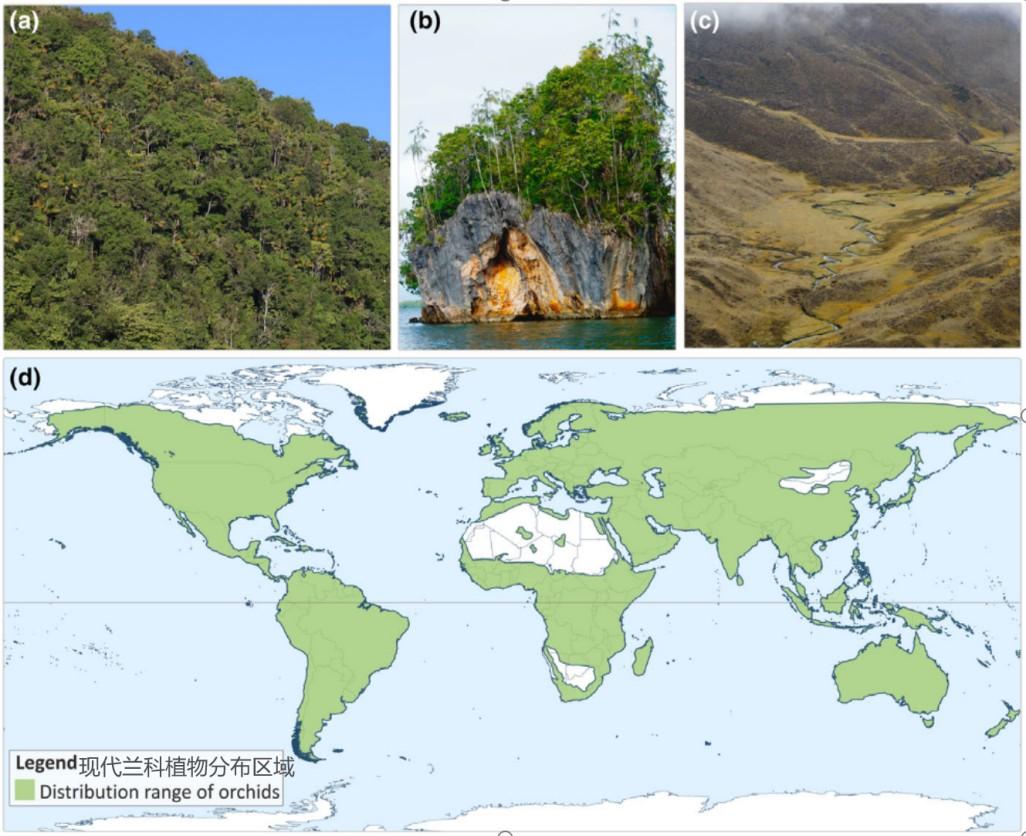
蘭科植物的現代分佈區域
(圖片來源:Pérez-Escobar et al.2024)

圖片說明:1.熱帶雨林多花蘭2.溫帶森林廣佈小紅門蘭3.溫帶草原溼潤地帶的紫花地丁
4.溼地生境中竹葉蘭5.荒漠邊緣地區的百歲蘭6.人工栽培的蝴蝶蘭
(圖片來源:朱鑫鑫、朱仁斌、金寧、魏澤、李光敏;製圖:李彤)
二、摒棄短板,躺平但不擺爛
生活在陰溼環境的腐生蘭天麻(Gastrodia elata)是反內卷的榜樣。在鬱閉且光照微弱的的森林中,努力爭奪生存資源以獲取更多營養物質是生存的關鍵(如紅杉拼命長高爭奪陽光),因此許多植物選擇在光照競爭中拼命內卷“光合技術”。生活在卷王圈子的天麻卻生的身材矮小,沒有根也沒有葉,全身上下最寶貴的就是它的塊狀根,這樣的天麻如果要靠“光合技術”提高競爭力似乎很難存活,於是天麻沒有拘泥於傳統思路,它們分析了環境和自身條件,不跟風捲“光合技術”,而是選擇“躺平”,逐步“卸載”掉光合相關基因,將製造養分的任務外包給真菌。這種截然不同的生存路徑,節省了大量維護葉綠體的能量成本,節省來的能量成本可以幫助天麻專注於發展分解真菌細胞壁,比如3倍擴張分解真菌細胞壁的幾丁質酶基因、通過海藻糖水解酶高效分解真菌菌絲中的養分來榨取營養,使其能在黑暗的森林底層穩穩地“躺贏”,過着衣來伸手飯來張口的神仙生活。

1.天麻全株2.天麻花序3.天麻塊狀根
(圖片來源:安紅旗、魏澤、趙宏;製作:李彤)
三、降本增效,薄利多銷
蘭科植物不僅是“反內卷王”,還深諳“降本增效”之道。胚乳是種子中儲存營養物質的重要營養包,但也同時會一定程度上增加種子的體積和重量。爲了擴大種子的擴散範圍,蘭科植物再一次選擇“斷舍離”,卸載掉產生胚乳的typeI Mβ MADS-box基因,成功把自己的種子進化成輕量級選手。沒有胚乳的蘭科植物單個蒴果內通常有上萬粒種子,這些種子僅0.3-14微克,形似灰塵,可藉助風力傳播數百公里,甚至附着在鳥類羽毛上遠行。這種“輕量化設計”大幅提升了種羣的擴散能力,讓它們能夠到達樹皮縫隙、岩石表面等特殊的生態位。
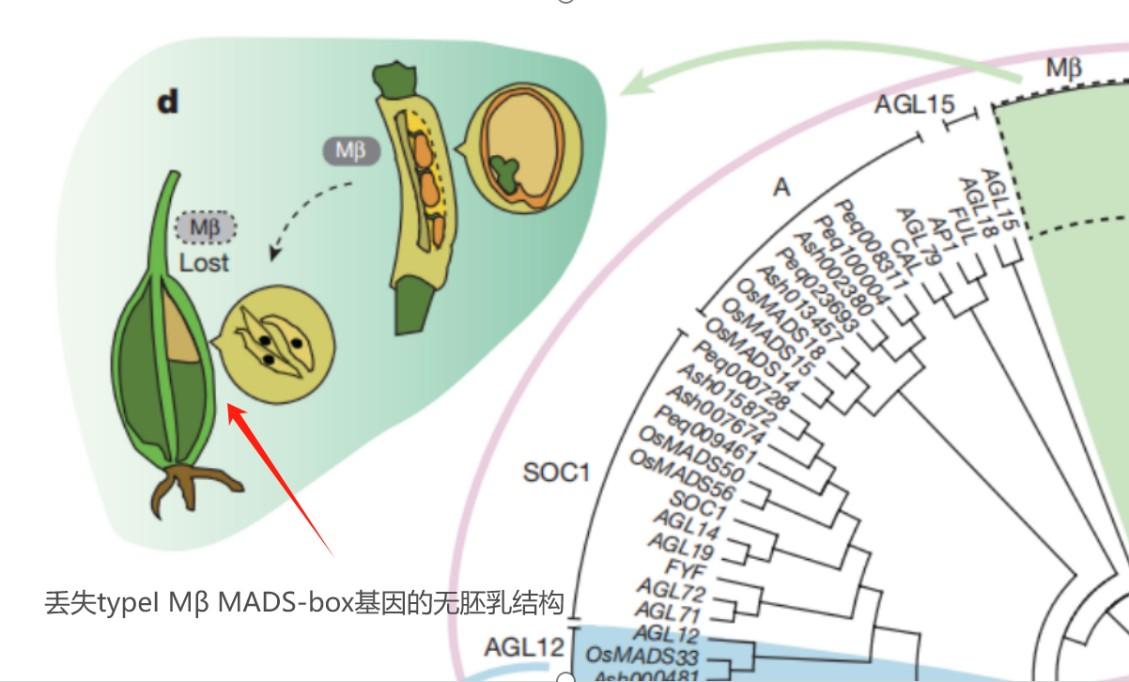
(圖片來源:ZHANG·G·Q et al.,2017;製圖:李彤)
四、主動適應環境,化被動爲主動
植物的生長髮育需要充足的營養物質,在遇到營養條件不足的情況時,蘭科植物沒有抱怨環境,而是主動改變,適應環境。
附生性蘭科植物在根部進化出了特殊的適應性構造,比如海綿表皮和根膜,這些組織可以幫助它們更好附生於其他植物(通常是樹木)、岩石和固體物上,並從雨水和空氣中收集水分和養分。比如野生蝴蝶蘭(Phalaenopsis aphrodite)大多生長在樹枝上,它們的部分根系會緊貼在一些灌木或纏繞在樹幹上,但不會吸取樹木的養分,只是依靠樹木吸取空氣中的養分水分,並不會對樹木造成任何傷害。這種附生特性幫助它們佔領了許多其他植物企及不到生境領地,而且這些生境之間存在很大差異,容易隔斷蘭科植物物種的基因交流(即生境隔離),有助於促進蘭科植物內部新物種的產生。


蝴蝶蘭
(圖片來源:李光敏)
五、創新進取新領域,填補“傳統技術”空白
近親繁殖會影響人口質量,植物也是。植物們爲了防止後代同質化,在胚乳中進化出了雜交屏障的功能,可阻止新形成的多倍體與其非多倍體祖細胞進行雜交,進而促進被子植物的進化。
缺少胚乳的蘭科植物也有自己的辦法,它們大膽創新,將花粉粒粘合成塊,形成花粉塊,花粉塊不會像花粉那樣漫無目的、廣撒網式的散播,而是可以附着在授粉昆蟲身上在花朵間進行一對一的傳粉。花粉塊的形成,是蘭科進化史上的一項關鍵創新,不僅促成了生殖隔離,有助於新物種的形成,還在該種羣的輻射分佈方面發揮重要作用。
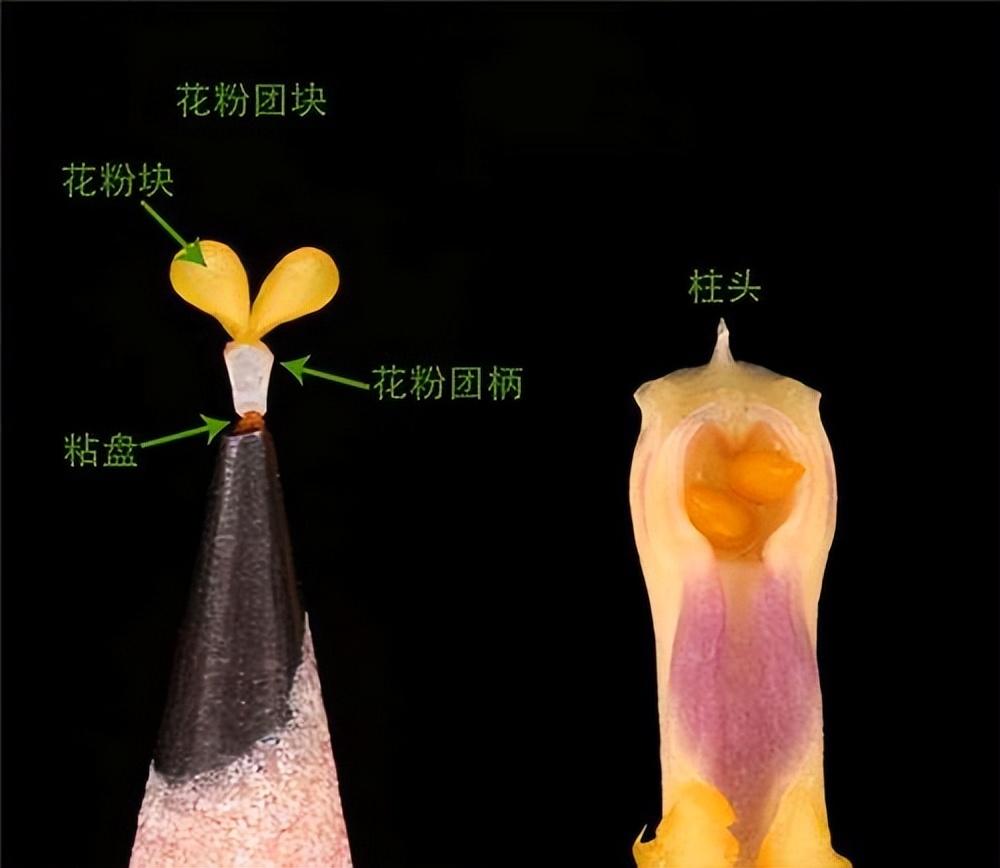
(圖片來源:引自Mark Whitten)
六、聚焦優勢,靈活迭代新策略
獨特的花粉團結構雖很好解決了後代同質化的問題,但也侷限了蘭科植物授粉的渠道,使得蘭科植物只能依靠蟲媒或者自花授粉,難以利用風媒傳粉。爲了使後代更優秀,蘭科植物只有很少一部分會選擇自花授粉,如大根槽舌蘭(Holcoglossum amesianum),所以蘭科植物對於昆蟲的需求隨之增加。如何吸引昆蟲?獨特的脣瓣結構發揮了優勢。
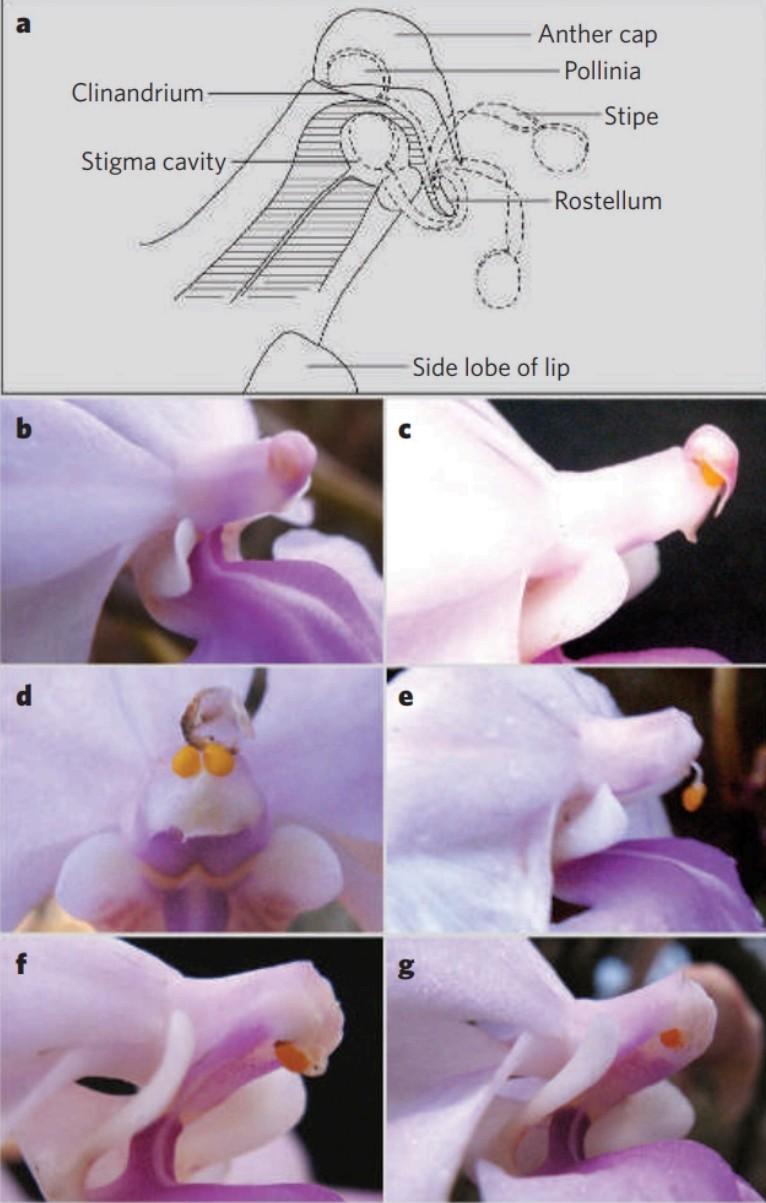
圖片:大根槽舌蘭自花授粉過程
a. 花粉從花葯運輸到柱頭過程中花部結構的排列及其運動(虛線)(在 c-g 中描述);b. 授粉開始前開放的花朵;c. 花葯帽打開並從蕊柱上脫落;d. 花絲頂端攜帶兩個花粉塊上升;e. 向下彎曲穿過蕊喙;f. 花絲接着向上朝柱頭彎曲;g.將花粉塊插⼊柱頭腔
(圖片來源:蓬斛閬苑、Liu et al.,2006)
脣瓣(修飾的花瓣)是蘭科植物其最顯著的特徵之一,可以吸引昆蟲併爲其提供採蜜時的“着陸平臺”。發現自己脣瓣優勢的蘭科植物,不斷放大自己的優勢,在脣瓣的形態、顏色、氣味等方向發力創新。部分蘭科植物(約有1/3)通過模擬、僞裝等手段,誘騙傳粉者爲它們傳粉,比如足莖毛蘭(Eria coronaria)利用脣瓣上的黃色斑塊模擬成美味的食物,吸引饞嘴的中華蜜蜂的光臨。

(圖片來源:昆明植物研究所官網)
南非的無報酬蘭花Disa pulchra與鳶尾科植物Watsonia lepida分佈區域重疊,於是它們模仿這種鳶尾科植物的顏色和花型,吸引它們的“客戶蟲蟲”前來覓食,昆蟲在兩者之間難以分辨,最終爲蘭花完成傳粉。

南非的無報酬蘭花Disa pulchra和鳶尾科植物Watsonia lepida對比
(圖片來源:Schlüter PM et al.,2008)
土蜂蘭(Ophrys speculum)脣瓣呈現金屬光澤的藍色斑塊,模擬雌性胡蜂腹部,同時還釋放出與雌性昆蟲相似的性激素信號,就像“藍牙信號一樣”,等待發情的雄性胡蜂前來配對傳粉。

土蜂蘭
(圖片來源:李佳儂)

“受騙的”胡蜂
(圖片來源:http://www.pharmanatur.com)
長瓣兜蘭利用花瓣上的黑色突出物模擬黑帶食蚜蠅的幼蟲食物,讓黑帶食蚜蠅母親誤以爲這是食物豐富的哺育場所,興高采烈地前來產卵,在產卵過程中爲長瓣兜蘭完成授粉。

1.長瓣兜蘭上的黑色突出物
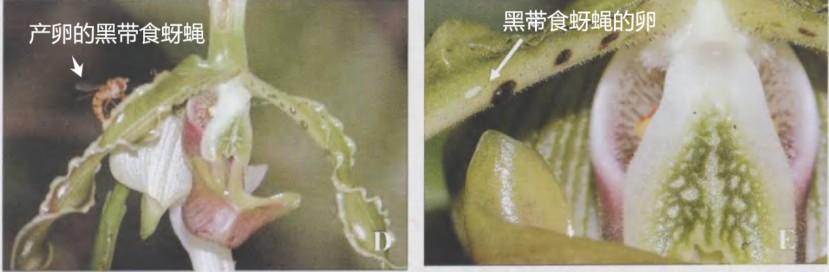
2.產卵的黑帶食蚜蠅3.黑帶食蚜蠅的卵
(圖片來源:昆明植物研究所官網;史軍等,2007)
當植物學家一層層剝開蘭科植物的進化奧祕時,也同時向我們展現並傳遞了蘭科植物堅強的生存智慧,讓我們在欣賞它們美麗外表的同時,也感嘆生命的奇蹟。當下,我們正面臨着文化、科技進步帶來的多重衝擊,如何才能更好度過這個充滿不確定性的時代?或許可以用謙遜的態度,學習參考自然的智慧,通過“分析環境與自身條件—規避短板不盲目內卷—聚焦優勢大膽創新—長期穩定發展”這樣的生存SOP去思考新的生存路徑,探索出適合自己的核心競爭力和立足之本。
作者:中國科學院植物研究所李彤
參考文獻:
1. 蔡文傑.蘭科植物的起源和進化[J].福建農林大學學報:自然科學版, 2019, 48(6)
:7.DOI:CNKI:SUN:FJND.0.2019-06-002.
2. 史軍,程瑾,羅敦,上官法智,羅毅波.利用傳粉綜合徵預測:長瓣兜蘭模擬繁殖地欺騙雌性食蚜蠅傳粉[J].植物分類學報,2007,45(4):551-560
3. CAI J, LIU X, VANNEST''E,K, et al. The genome sequence of the orchid Phalaenopsis equestris[Jl. Nat Genet, 2015,47:65-72
4. CHRISTENHUSZ·M J,BYNG·w..The·number·of.known''pS''species in''the world and its annual.increaseLant[J].·Phytotaxa,·2016,261(3):201-217.2.
5. Department of Plant Biology, Swedish University of Agricultural Sciences and Linnean Center for Plant Biology, Uppsala 75007, Sweden
6. Givnish, T. J. et al. Orchid phylogenomics and multiple drivers of their extraordinary diversification. Proc. R. Soc. B 282, 1553 (2015)
7. Givnish, T. J. et al. Orchid historical biogeography, diversification, Antarctica and the paradox of orchid dispersal. J. Biogeogr. 43, 1905–1916 (2016)
8. Jiao, Y., Peluso, P., Shi, J. et al. Improved maize reference genome with single-molecule technologies. Nature 546, 524–527 (2017). https://doi.org/10.1038/nature22971
9. Pérez-Escobar,et al., Forest, F., Nargar, K., Renner, S.S., Baker, W.J. and Antonelli, A. (2024), The origin and speciation of orchids. New Phytol, 242: 700-716.
10. Roberts, D. L. & Dixon, K. W. Orchids. Curr. Biol. 18, R325–R329 (2008)
11. Schlüter PM, Schiestl FP. Molecular mechanisms of floral mimicry in orchids. Trends Plant Sci. 2008 May;13(5):228-35. doi: 10.1016/j.tplants.2008.02.008. Epub 2008 Apr 16. PMID: 18424223.
12. WU Z Y, RAVEN P H, HONG D Y. Flora of China M. Beijing: Science Press, 2007:25
13. YEUNG E C.A perspective on orchid seed and protocorm development[J].Botanical studies,2017,58:1-14.
14. ZHANG·G·Q,·LIU.K.W,·LI·Z,·et·a1.2.The·Apostasia·genome and.the.evolutionof.orchidsJ549:379-383.Nature.·2017
15. Zuntini, A.R., Carruthers, T., Maurin, O. et al. Phylogenomics and the rise of the angiosperms. Nature 629, 843–850 (2024). https://doi.org/10.1038/s41586-024-07324-0