爲何醫用蛋白質製劑會賣出“天價”?從研發到臨牀它們經歷了什麼?
在腫瘤治療、自身免疫疾病等領域,醫用蛋白製劑正成爲無數患者的“救命稻草”。從治療癌症的單克隆抗體,到拯救糖尿病患者的胰島素,再到治療罕見病的酶替代製劑,這些由活細胞“生產”的生物藥,憑藉精準靶向性改寫了許多疾病的治療史。
但與此同時,它們的價格卻讓不少患者望而卻步:2021年,某個針對淋巴瘤和實體瘤的CAR-T細胞治療產品上市後不久,就廣受社會關注,其治療費用高達120萬元。這些能救命的“蛋白”,爲何會賣出“天價”?它們從實驗室到患者手中,經歷了怎樣的旅程?
從“無藥可醫”到“精準治療”:醫用蛋白製劑的誕生意義
生物藥通常是指利用蛋白質、酶、單克隆抗體、疫苗和肽等製備而成的醫用製劑,因其高特異性、更高的效力和靶向能力、更低的副作用,在癌症、糖尿病、免疫疾病和傳染病等治療領域脫穎而出。在傳統小分子藥物時代,許多複雜疾病因難以找到精準靶點而陷入“無藥可醫”的困境。醫用蛋白製劑的出現,打破了這一侷限。
從細胞到製劑的“萬里長征”
要理解醫用蛋白製劑高價的原因,首先要揭開其製備流程的神祕面紗。從研發到生產的全流程,堪稱一場“精度與耐心的考驗”。
步驟1:找到“生產工廠”並高效運轉——大規模發酵/細胞培養
生物藥的核心是具有治療活性的蛋白質,但蛋白質無法直接“合成”,必須依賴活細胞作爲“生產工廠”,然後在生物反應器中進行大規模培養。在細胞培養過程中,對環境的要求極高,通常需要維持在相對較高的溫度(高於30攝氏度)和中性pH條件下,保持至少十天時間,直到足夠的蛋白質合成並分泌至胞外爲止。從開始到收穫,期間任何微小波動都可能導致細胞死亡或蛋白表達異常。
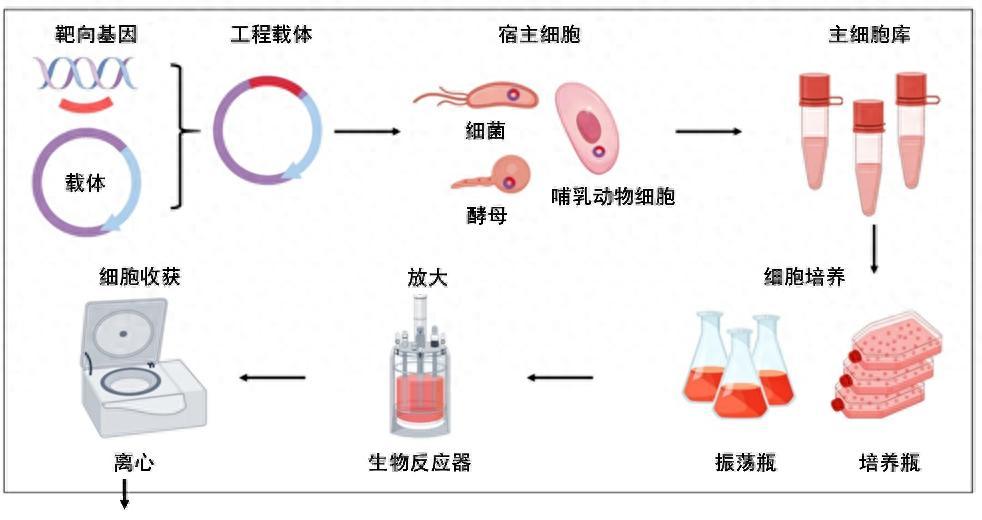
生物製藥生產的上游工藝示意圖
(圖片來源:Advanced Drug Delivery Reviews)
步驟2:“提純”——從混合物中找到“黃金分子”
細胞培養結束後,培養液中除了目標蛋白,還含有大量雜質(細胞碎片、雜蛋白、病毒等),這對蛋白純度提出了較高的要求。分離和純化蛋白質的傳統方法是色譜法,往往需要通過多步層析(“類似篩子層層過濾雜質”)及過濾等工藝,將目標蛋白的純度提升至99.9%以上——這相當於從1噸混合物中精準提取出1克“純金”。與此同時,還面臨着色譜法處理能力有限,所用色譜柱耗材價格昂貴的問題,在這個過程中也會產生大量的液體廢物,提純成本較高。
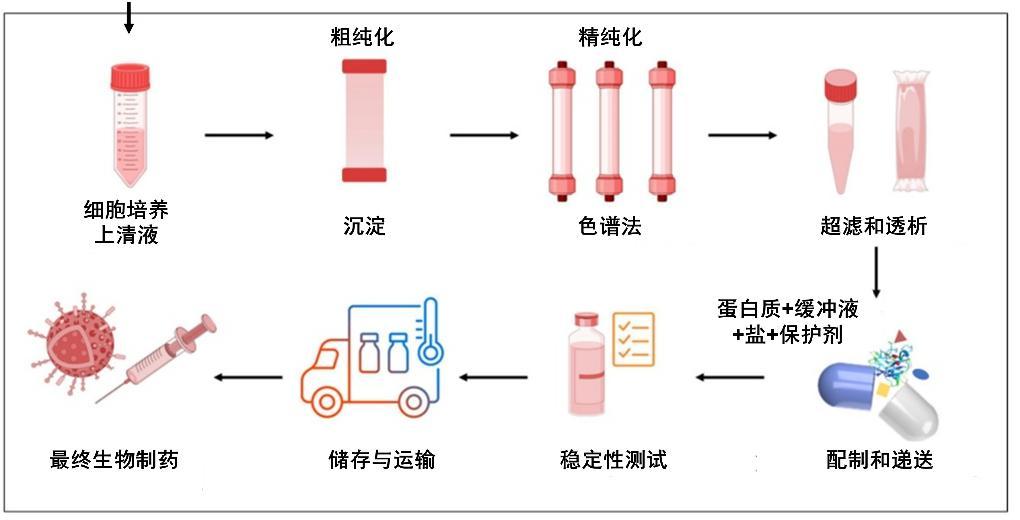
生物製藥生產的下游工藝示意圖
(圖片來源:Advanced Drug Delivery Reviews)
步驟3:製劑與質控——確保“救命藥”的安全
提純後的蛋白需製成穩定的製劑(如注射液、凍乾粉),這包括配製與混合、灌裝等步驟,還需嚴格質控:即無菌性、活性、穩定性等數十項檢測。在整個生產過程中,蛋白質會經歷多種破壞因素,如低pH、高鹽、凍融、光照、振盪、剪切等,這些因素都可能會造成蛋白質的結構變化或降解,從而影響生物藥的質量。
不僅僅是“生產成本高”
醫用蛋白製劑的高價,遠非“生產複雜”能完全解釋。其背後是多重因素的疊加:
1.研發成本驚人
蛋白質天性“嬌弱”,是由數千個氨基酸像串珠子一樣連起來的大分子,結構極其複雜——就像一件精密摺疊的絲綢襯衫,稍微遇到高溫、震動或酸鹼環境,就會“散架”變形,失去藥效。例如單克隆抗體(mAb)分子由多個區域組成,包括兩個抗原結合片段(Fab),一個可結晶片段(Fc)和一個鉸鏈區域,分子量達到150千道爾頓(相當於8333倍的水分子量,水的分子量爲0.018千道爾頓),分子本身結構複雜,同時其連接Fab和Fc的鉸鏈區域具有較高靈活性。更麻煩的是,溶液中的蛋白質還會“抱團”,就像人羣擁擠時容易扎堆,蛋白質分子也會互相吸附、聚集,形成沉澱。這不僅浪費原料,還可能引發過敏反應。一款新藥從早期研發到臨牀試驗再到上市,投入成本超20億美元,且藥物的臨牀試驗風險較大。
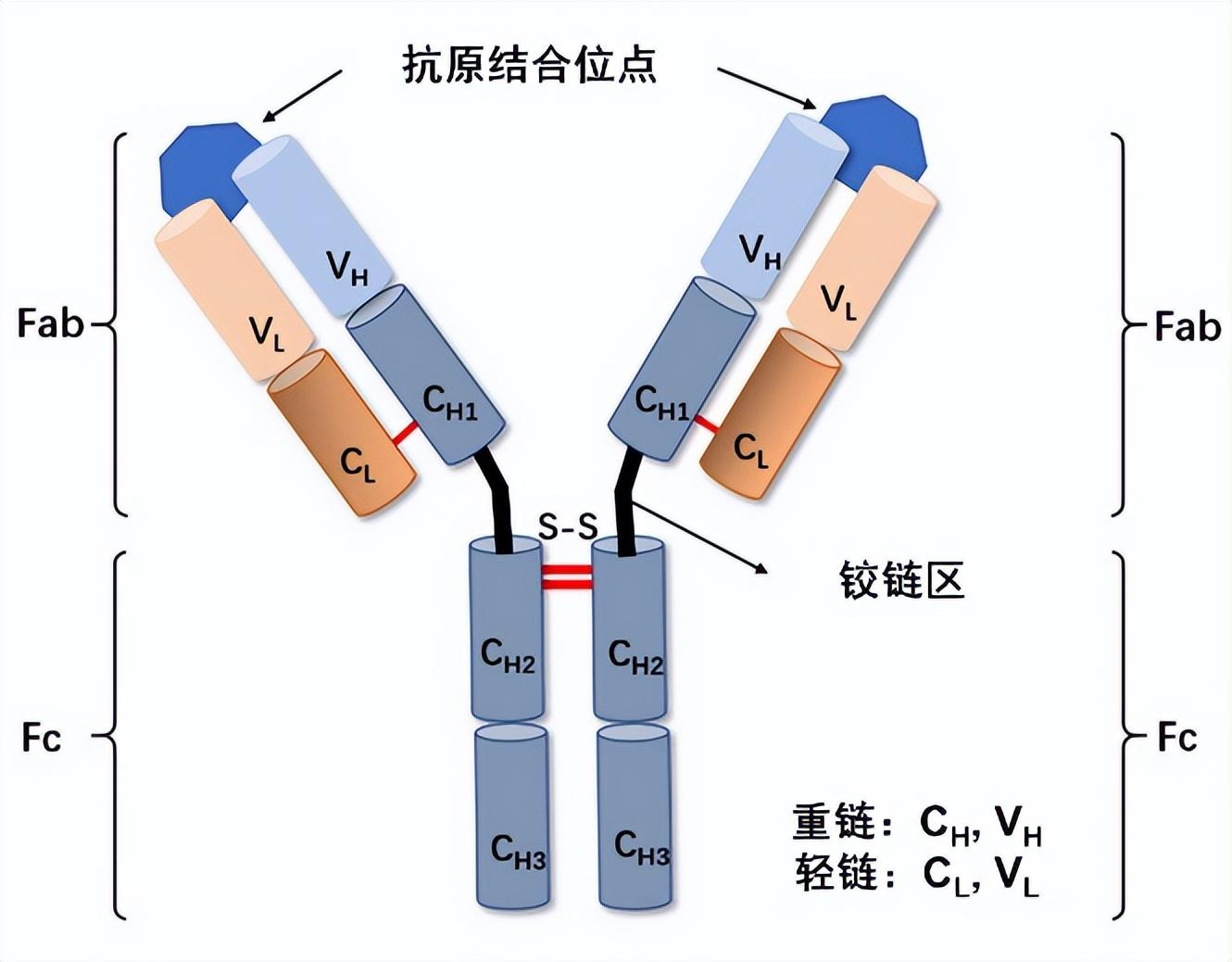
單克隆抗體的一般結構
(圖片來源:Separation and Purification Technology)
2.給藥手段的挑戰
醫用蛋白製劑的給藥方式,影響着患者的使用體驗和治療成本。總體而言,高於90%的批准生物製劑是侵入性的,包括靜脈注射、皮下注射、肌肉注射等。
靜脈注射有助於立即和連續地將藥物輸送到循環系統,但需要在醫院由醫護人員非常謹慎地調整劑量。肌肉注射是藥物在人高度血管化的肌肉內輸送,使血液能夠均勻快速地吸收並納入體循環。這種給藥方式高達全球注射總量的75%,但可能會引發一些不必要的問題,例如骨膜炎,組織壞死,感染,神經和血管損傷等。
非侵入性藥物可以通過以下三種方式給藥:局部(包括眼科)、舌下含服或口服。局部給藥是這些類型中最常見的(50%),其次是舌下含服(25%)和口服給藥途徑(25%)。非侵入性藥物給藥總體上更安全,患者依從性和滿意度更高,但實際獲批的非侵入性生物製劑數量並沒有明顯或逐年增加的趨勢。例如,口服生物製劑深受患者青睞,但其最具挑戰性——保護蛋白質藥物免受胃酸和酶的消化、使植物細胞在腸腔內破裂以釋放蛋白質藥物、將治療性蛋白質通過腸上皮細胞輸送至免疫或循環系統。
基於這些給藥方式的限制,如靜脈注射的醫護人力成本、新型給藥技術的研發投入、頻繁注射的痛苦與間接損傷等,進一步抬高了生物製劑的成本。
3.儲存運輸艱難
將生物製劑純化至純度高於99%是生物製劑生產中最昂貴的一部分。經過如此大的投入,因生物製劑脆弱的性質,藥物保質期很短,需要全程冷鏈(通常爲2-8攝氏度)進行儲存和運輸,相對普通貨車運輸耗能巨大,同時這個環節非常不穩定,運輸過程中一旦出現溫度波動便可能會導致藥物失效。
4.專利保護限制
對企業而言,需在專利保護期(通常20年)內收回成本,而藥物上市時往往僅剩10年左右的獨家銷售期。這是因爲專利通常在藥物研發早期(如臨牀前研究階段)就已申請,而從專利申請到藥物完成三期臨牀試驗、獲得監管部門批准上市,平均需要10年左右。在這短短十餘年的獨家期內,企業不僅要覆蓋數十億甚至上百億美元的研發投入,還要承擔藥物上市後監測(如不良反應追蹤)、生產工藝優化等持續成本。爲應對專利到期後的市場競爭,企業往往需要在專利期內快速提升銷量,這也間接推高了生物藥的初期定價。
5.市場規模有限
全球已知的罕見病已有至少7000種,其中多數疾病的患者人數僅爲百萬分之一甚至千萬分之一。許多蛋白製劑針對罕見病而研發,但患者羣體少,且患者分佈分散,藥物的流通和配送成本也隨之上升,因此難以通過“薄利多銷”降低價格。這種“小衆需求”直接導致生產規模難以擴大,只能“小批量、多批次”進行,而每批次生產的啓動成本(如生物反應器清潔、耗材更換、質控流程)是固定的,分攤到每支藥物上的成本自然居高不下。
未來可期,讓“天價藥”走下神壇
醫用蛋白製劑的“天價”困局,本質是一場與蛋白質“嬌弱天性”的持久戰。隨着生物技術與多學科的深度融合,醫用蛋白製劑正從“小衆高價”向“大衆可及”邁進,具體突破路徑已初現端倪:
在生產端,新型細胞工程技術正打破傳統培養的效率瓶頸,如2025年發佈的使用微載體和生物反應器進行封閉且可擴展的3D培養工藝,在3升生物反應器的優化條件下,可實現間充質基質細胞的高倍擴增,細胞存活率高,回收效果好。
純化環節的創新同樣值得期待,一些如結晶法等低成本純化手段正在被應用。研究者們選擇帶電聚合物、聚糖、生物模板等物質作爲成核劑(一種能夠促進結晶的物質類別),利用其與蛋白質分子的表面發生直接或間接的化學相互作用,可以得到穩定性和生物利用度更高的蛋白質藥物晶體。
而微球緩釋技術,可以降低給藥頻率,既可以長效控制,也可以降低冷鏈運輸的頻次與成本。最近,一種氣體剪切微流控策略製造的微球,該微球含有三個負載胰島素的腔室,腔室的釋放數量可以隨血糖濃度而調整,可以實現對血糖水平35小時的精確控制,並且封裝效率、穩定性和生物相容性均較好。
科技創新的終極目標,是讓每一項進步都能惠及普通人。或許在不久的將來,這些曾讓人望而卻步的“蛋白製劑”會像抗生素一樣,成爲觸手可及的“救命常規藥”,而這背後,是無數科研人員對“精準治療”與“普惠醫療”的雙重追求。
出品:科普中國
作者:郝琪(中國生物工程學會會員、河北工業大學在讀博士)
監製:中國科普博覽