以線蟲爲靈感,我們造出1毫米的機器人,可進入大腦精準遞藥滅瘤
大腦是非常精密的器官,掌管着人類的思維和行動,此處發生的任何意外都可能導致人類的行動或思維受損。因此一旦大腦中出現腫瘤,外科醫生往往會陷入兩難:傳統開顱手術需要切開層層腦組織,稍有不慎便可能導致失語、偏癱等不可逆損傷;放療雖能穿透顱骨,但卻會無差別破壞腦細胞,無論是腫瘤還是健康腦細胞都會受損;而化療藥物又有可能被腦血屏障攔截而無法抵達腫瘤細胞處。因此如何向腦中精準投放藥物消滅腫瘤細菌就成了科學家們研究的重點。
仿生設計啓發:線蟲如何啓發我們造機器人?
深圳先進技術研究院徐天添團隊近期開發出一種毫米級柔性機器人,目標是將其用於在不損傷腦組織的前提下,深入大腦精準遞送藥物。之所以提出這一設想,是因爲大腦內部結構複雜,蛛網膜下腔的間隙不足1毫米,腦溝回縱橫交錯,且神經組織對外界干擾極爲敏感。傳統的剛性機器人易損傷腦組織,過度柔性和小型化則又帶來運動能力下降等問題。
一次偶然的實驗中,研究人員觀察到土壤中的秀麗隱杆線蟲(長度約1毫米)可以通過波浪狀蠕動,穿過比自己更狹小的縫隙。這種運動模式和柔性體態,使它能在複雜地形中有效前行。受到啓發,團隊決定仿照線蟲的結構與運動方式,通過仿生設計製造機器人。他們以患者自身血液中的纖維蛋白爲基礎材料,結合磁性驅動技術,研製出一種直徑約1毫米、彈性模量接近腦組織的柔性機器人。該機器人具備良好的形變能力和生物相容性,可在腦脊液環境中自如運動,爲穿越顱內微結構提供了新工具。

血凝膠機器人實物圖
(圖片來源:研究團隊供圖)
用患者血液製造一個機器人
任何外來材料進入大腦,都有可能被免疫系統識別爲異物,引發排異反應。免疫細胞會主動聚集、包圍並清除這些異物,過程可能伴隨炎症,甚至損傷周圍組織。這對植入性醫療設備提出了極高的生物相容性要求。傳統機器人常用的金屬或合成材料,很難在大腦這一高度敏感區域中長期存在而不被免疫系統排斥。
爲了避免這一問題,研究團隊採用患者自身血液中的纖維蛋白作爲機器人主體材料。纖維蛋白是一種在傷口癒合中發揮關鍵作用的天然成分,具有良好的生物相容性。團隊將其與磁性顆粒混合,製成柔性凝膠狀材料,用於構建機器人的骨架。這種材料不僅具備柔軟性,其彈性模量(約爲100千帕)也接近腦組織的物理特性,有助於減小植入後的機械刺激。
在活體動物實驗中,這種“血凝膠機器人”被植入豬腦後,未引起白細胞數量異常或炎症因子升高。各項免疫指標保持穩定,說明機器人能在體內長期存在而不觸發明顯的免疫反應。這一設計爲實現安全、高效的腦部治療奠定了基礎。
依靠磁場,機器人在大腦中也活動自如
在避免了自體免疫反應之後,如何讓這根柔軟的血凝膠機器人在大腦複雜微環境中主動移動,便成爲下一個核心課題。研究團隊在機器人材料中嵌入納米級磁性顆粒,使其能夠響應外部磁場。在程序控制下,機器人可以根據磁場的變化靈活調整運動方式,以適應不同的解剖結構和行進路徑。
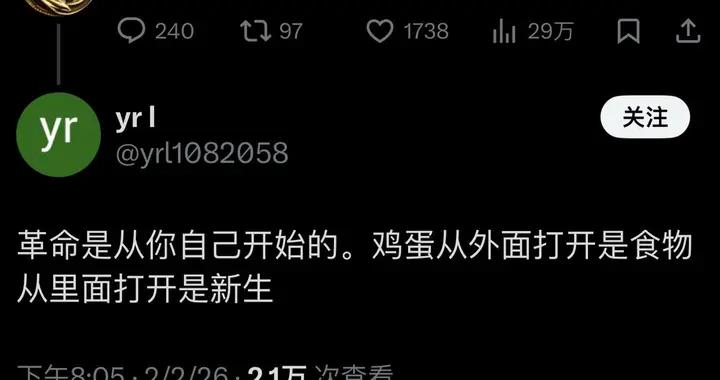
具體來說,在外部可編程磁場的作用下,這根毫米級的纖維機器人可以以三種仿生模式靈活轉換:在交變磁場下,它會像線蟲一樣產生縱向的波浪形擺動,形成持續的推進力;當需要依附組織表面時,纖維表面的微弱粘附力讓其能抓住微小固定點,並通過自身的波浪形變完成蠕動前行;而在面對通道急轉或截面突變的拐點時,機器人會切換到滾動模式,帶着磁性顆粒沿着自身軸線翻滾,輕鬆越過障礙。這些精妙的運動機制經過3D打印的大腦溝回仿真模型和離體豬腦實驗雙重驗證——血凝膠纖維機器人能夠連續通過數級米字型擋塊,抵達預設的目標位置,並且全程未對軟組織造成任何機械損傷。
離體豬腦皮層上運動的“線蟲”機器人
(圖片來源:研究團隊供圖)
機器人雖小,但也自帶精準導航!
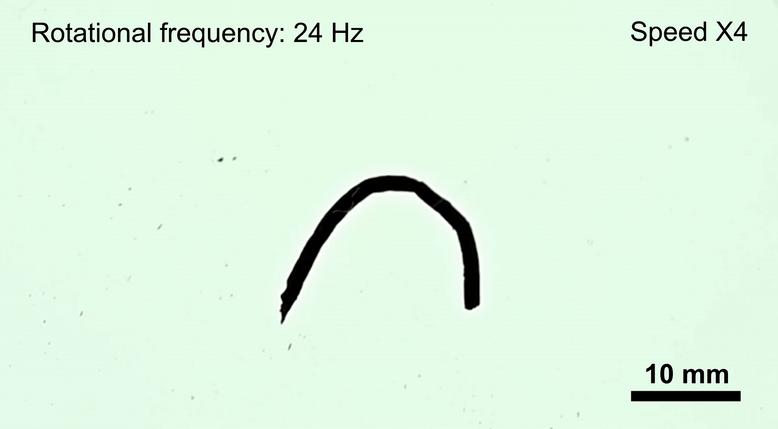
爲了實現藥物的精準遞送,研究團隊將機器人與X射線成像系統結合,實現實時可視化導航。在外部磁場驅動下,醫生可通過成像系統監控機器人的運動軌跡,並根據路徑情況動態調整磁場參數,引導其準確抵達腫瘤區域。
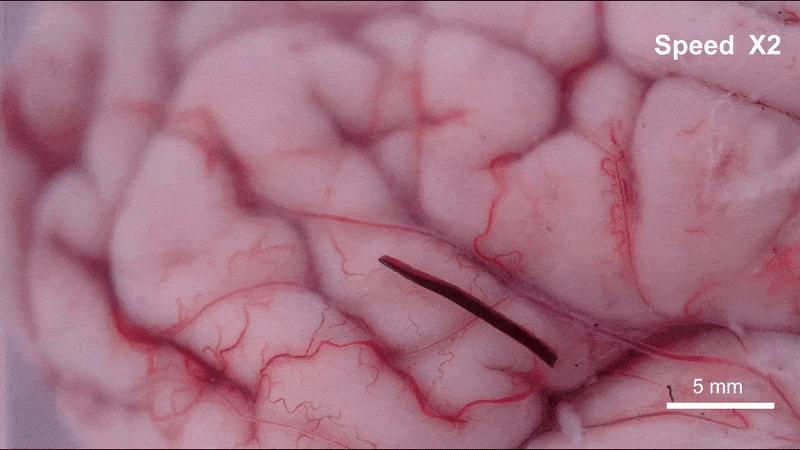
藥物的攜帶與釋放機制也集成在機器人本體中。實驗表明,在磁場強度低於20毫特斯拉、頻率低於6赫茲的條件下,機器人結構保持穩定,藥物不會提前釋放;一旦抵達目標區域,通過提高磁場強度和頻率(約50毫特斯拉、24赫茲),機器人會迅速碎解爲微米級顆粒,將所載藥物(如阿黴素)局部釋放到腫瘤組織內。
這種控制方式實現了空間和時間上的精準釋放,減少了藥物對正常腦組織的影響。研究人員在18頭小型豬的腦膠質瘤模型上分組開展驗證,結果顯示機器人治療組的腫瘤體積只有對照組的四分之一左右,而活體豬的血液細胞計數和多項生化指標依舊保持在正常水平,未見炎症反應或器官功能損傷。更難能可貴的是,機器人執行完任務後可在體內逐步分解,無需再次取出手術,這一特性將爲患者帶來更少的身體負擔與心理壓力。
在高頻交變磁場下“線蟲”機器人碎片化,釋放內部藥物
(圖片來源:研究團隊供圖)
線蟲機器人研究意義:從實驗室突破到臨牀曙光
當前,研究團隊的“線蟲機器人”已在活體大型動物實驗中展現出巨大潛力,在活體動物實驗中,這種毫米級機器人將腫瘤區域的藥物濃度提高至傳統靜脈注射的十倍以上,爲突破血腦屏障提供了新方法。前文提到的實驗結果也顯示其具備良好的療效和安全性,爲後續臨牀轉化提供了初步依據。
儘管距離臨牀應用還需攻克長期生物安全性驗證、量產標準化等難關,但其意義已遠超技術本身。未來若實現轉化,患者或僅需通過微創注射接受治療,告別開顱手術的創傷與感染風險,治療週期實現大幅度縮短。對於深部腫瘤患者,這種“打針送藥,磁場驅動,X射線導航”的治療模式,將徹底改寫傳統治療手段,讓精準醫療真正穿透血腦屏障。
“這不僅是送藥工具的升級,更是治療邏輯的顛覆。”徐天添表示,“當機器人能像‘自體細胞’一樣在腦中自由穿行時,人類對抗腦疾病的戰場,將從‘傷敵一千自損八百’的陣地戰,轉向‘精準狙殺’的智能戰。”
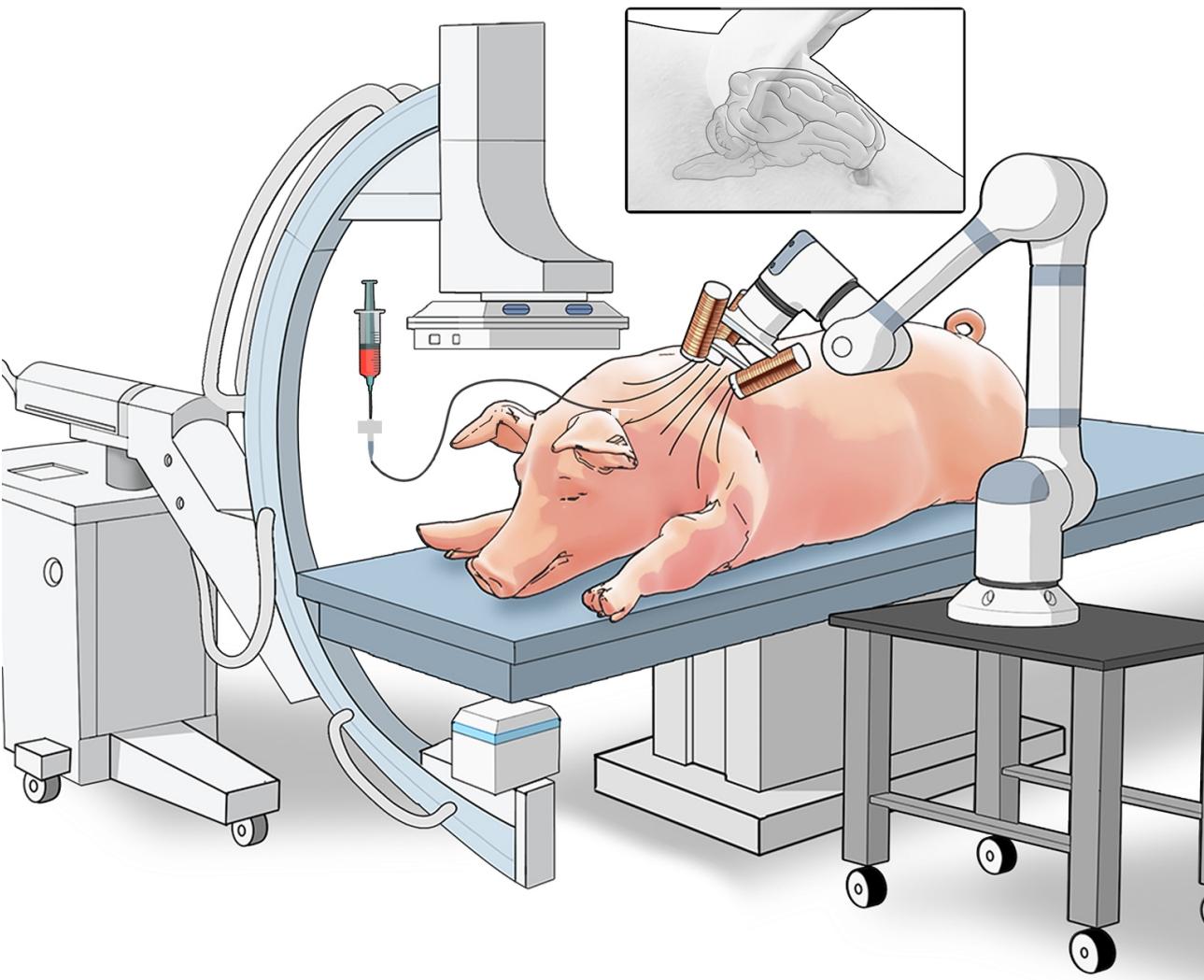
活體豬體內實驗驗證
(圖片來源:研究團隊供圖)
研究團隊正在進一步優化線蟲機器人的材料和結構性能。一方面,他們嘗試引入響應性更高的磁性材料,以提升機器人在複雜腦環境中的運動精度和控制能力。另一方面,團隊也在探索將光學成像和超聲成像等多種導航手段結合,實現更高分辨率的實時定位。
在基礎研究方面,團隊關注機器人與腦組織界面的流體力學特性,希望通過微流控設計減少對微環境的擾動,並提高藥物釋放的效率。同時,他們也計劃測試機器人在攜帶不同類型藥物或基因載體時的釋放行爲,以推動個性化治療的發展。
未來,該技術也有望擴展至腦部以外的複雜部位,例如脊髓損傷修復或心血管系統的微創干預。通過不斷改進材料、驅動和導航策略,研究人員希望將這類柔性機器人發展爲醫學微創治療中的通用平臺。
出品:科普中國
作者:徐天添(中國科學院深圳先進技術研究院)
監製:中國科普博覽