一個本該“切掉就好”的皮膚癌,這位 34 歲女性爲啥反覆治不好?
每次去醫院看病,你有沒有好奇過:醫生到底是怎麼一步步判斷出我們得的是什麼病?有的時候,醫生沒說幾句就開了一堆檢查單,抽血、拍片、化驗……這些五花八門的檢查項目,到底有什麼用?
今天這個真實而曲折的病例故事,或許能幫你解開心中的疑惑。
一反常態的“溫和”癌變
故事的主角是一位 34 歲的美國女性,因爲 HPV 相關的皮膚和黏膜疣狀病變日漸加重去醫院就診。醫生進行取樣活檢,在她的身體經常暴露於日光的部位發現了多處皮膚鱗狀細胞癌病變。
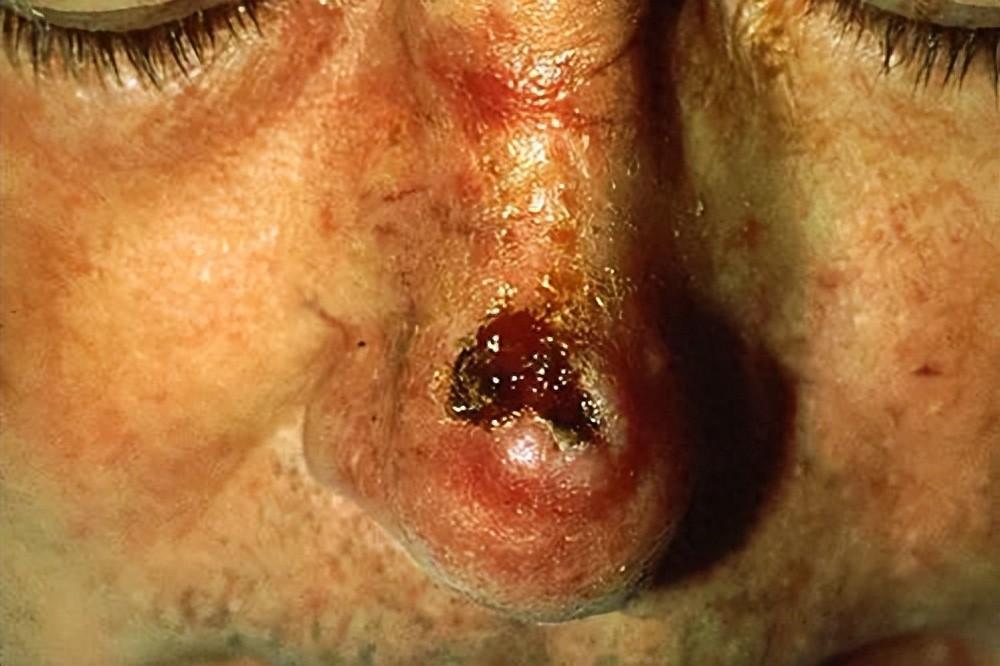
皮膚鱗狀細胞癌 圖源:wikipedia
皮膚鱗癌主要和紫外線對皮膚細胞 DNA 的損傷有關,所以對於皮膚缺乏黑色素保護的白人羣體來說很常見,佔所有皮膚惡性腫瘤的 20%[1]。好在常見的皮膚鱗癌通常爲惰性腫瘤,大多數預後良好,5 年治癒率超過 90%,轉移率也低(<4%)[1]。
如此“溫和”的癌症按理說不難治,然而,這位女士卻是一個例外。經過積極的手術治療後,她的額頭很快就出現了復發竈——
再治療,又復發
是不應該選擇手術嗎?
歐洲的權威指南將手術治療推薦爲常見原發性皮膚鱗癌的一線治療方案[2]。所謂“一線治療方案”,是指針對某種疾病,根據當前醫學證據、指南推薦和患者具體情況,優先選擇的、最理想且最可能帶來最佳療效的標準治療方案。這說明多數時候,手術治療對於皮膚鱗癌的效果是可靠的。
不過,侵襲性的癌症如同大樹的樹根,即便連根拔除甚至沿着樹根周圍再切一圈,也很難保證更遠、更深處沒有殘餘的根鬚,而這些殘留的“根鬚”各自都有潛力長出新的“大樹”,並繼續向更遠、更深處紮根,這便是爲什麼惡性腫瘤容易復發、轉移且難以根治。所以,雖然手術治療皮膚鱗癌的效果可靠、治癒率高,但復發也並非不可能。
醫生們提出了新的推測:是不是上一次手術沒能徹底清除癌細胞?
於是,醫生又爲她進行了分期莫氏顯微手術。
這項手術由外科醫生和病理科醫生配合完成,在外科醫生切除肉眼可見的病變組織後,病理科醫生立即將組織處理好並用顯微鏡檢驗,只要在組織的任何邊緣發現有癌細胞殘留,外科醫生就會順着對應的部位繼續擴大手術範圍,直到所有組織的邊緣不再能找到癌細胞。
這樣一來,既能確保癌細胞被徹底切除乾淨,又能精準地確定手術範圍,最大程度地保留健康組織、減少手術創傷。切除完成後,如果創面較大,可以移植自身的健康皮膚或使用人造皮膚覆蓋創面,如果創面較小,也可以期待自然癒合。
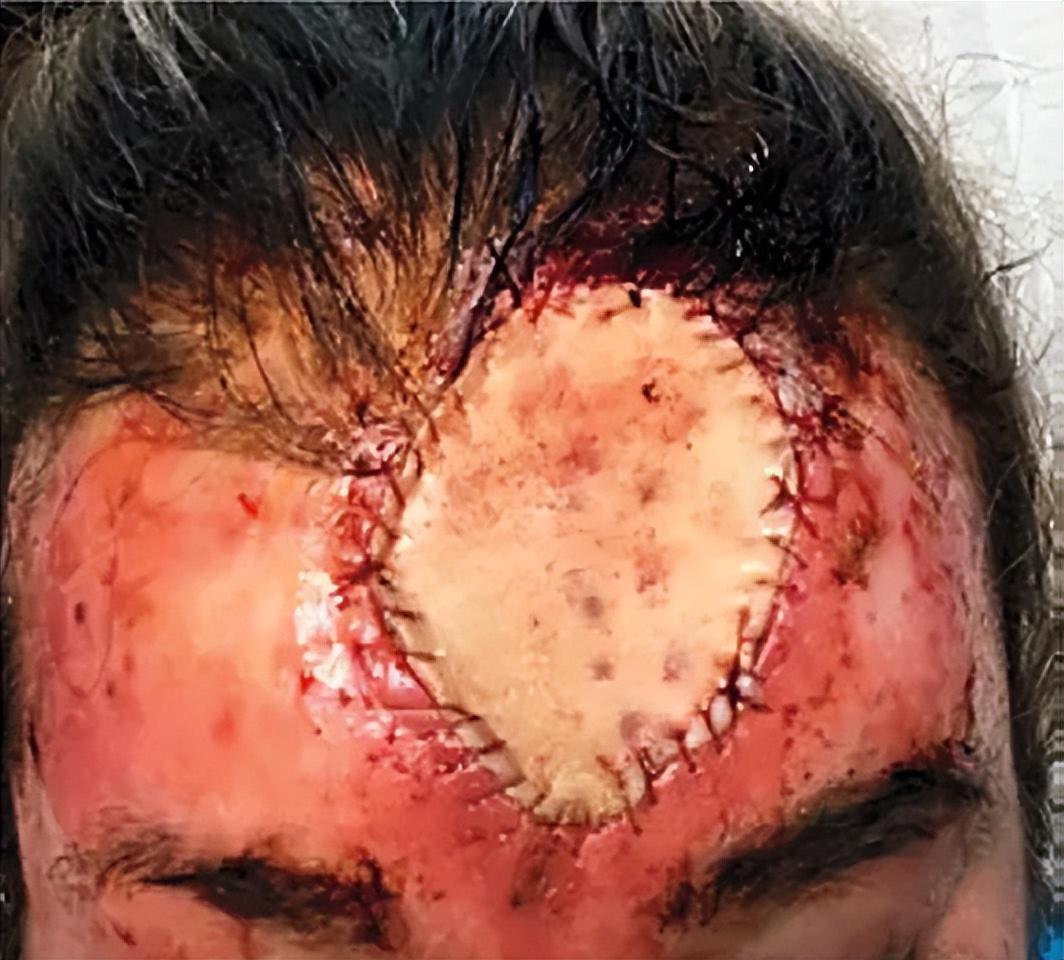
莫氏手術術後,以自身健康的腹部皮膚覆蓋手術創面。圖片來自本案例文獻
在如此精細的操作之下,莫氏手術通常能給皮膚鱗癌帶來極高的治癒率。一項納入 647 例患者的前瞻性隊列研究[3]顯示,侵襲性皮膚鱗癌患者在接受莫氏手術後,五年內無復發的幾率在 99% 以上。
所以理論上,這位女士再次復發的概率應該很低了。然而,事情的發展卻不盡如人意,經歷過莫氏顯微手術的額頭竟然第三次復發了皮膚鱗癌。
裏應外合的免疫治療
這一次,在上次手術的植皮區域之外,整片額頭都出現了廣泛的鱗癌病變,腫瘤的侵襲深度突破真皮組織到達了深部的肌層,還有顯著的促纖維增生反應以及神經周圍和血管周圍的浸潤。
根據美國癌症聯合委員會(AJCC)分期標準,此次腫瘤被判定爲 III 期(T3,N0,M0),根據布萊根婦女醫院皮膚鱗癌分期系統,該腫瘤被判定爲 II 期(T2b,N0,M0)。醫生再次用莫氏手術爲她移除了病竈,又用生物材料幫助額頭皮膚完成了創面的癒合。
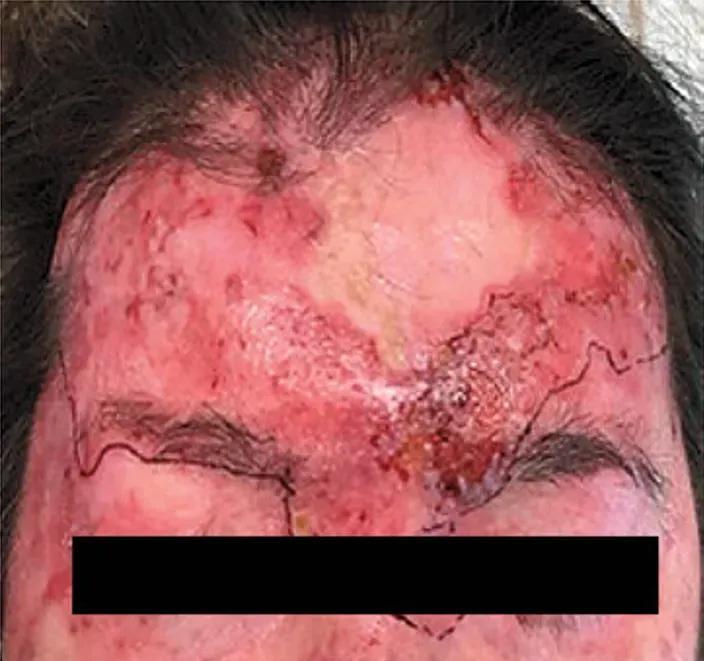
皮膚鱗癌在上次手術植皮區域外復發。圖片來自本案例文獻
除了手術外,醫生還爲她實施了免疫治療。
我們的免疫系統可以識別自身的老廢細胞、癌變細胞、外來入侵的異物、病原體等,作出免疫應答來限制或清除它們。而免疫應答的強度、質量則還有專門的“質控員”進行把關,以防免疫反應過於激烈,危害自身。這個質控員叫做“免疫檢查點”。
一些腫瘤細胞可以在免疫系統的“巡邏員” T 細胞抬起槍口的時候,哄騙免疫檢查點通知 T 細胞“放下槍,這是自己人”,從而躲過免疫系統的監管,放肆擴張。此時,如果用藥物阻斷免疫檢查點,T 細胞失去了昏頭上司的限制,就又會調轉槍頭,發動全身的免疫系統對腫瘤細胞展開攻擊[4]。
可以想見,針對那些擅長利用免疫檢查點的腫瘤,只要能找對免疫檢查點、用對抑制劑,就能讓免疫系統重新建立對於腫瘤的抵抗力。將這種免疫療法作爲輔助治療用來清除殘餘癌細胞、預防復發將會非常有效,而皮膚鱗癌恰好就在射程之內。
大量的臨牀研究[5]發現,對於少數無法通過手術完全治癒的皮膚鱗癌患者,免疫療法較其它的細胞毒性化療藥物有更高的安全性和更好的治療表現,能極大地改善皮膚鱗癌術後復發患者和晚期轉移患者的治療結局,還能在新輔助治療的聯合方案中部分甚至完全緩解病變,避免原本必要的手術和放化療,或者降低手術、放化療的治療強度。
那麼,經過莫氏顯微手術和免疫治療的裏應外合,這位女士的皮膚鱗癌能否終於迎來徹底的治癒呢?
還是不行。
抽絲剝繭的病因分析
對於絕大多數人都有效的治療方案,在這位女士身上卻總是徒勞無功,多次治療後不僅反覆復發,竟然還有逐漸加重的趨勢,到底哪兒出了問題?
醫生沒有選擇繼續提升治療強度,盲目地給她的治療“下猛藥”,而是決心追根溯源,找到治療的突破口。在對她的腫瘤組織進行了全面的組織學和分子特徵分析後,果然發現了不尋常的地方。
腫瘤組織中,紫外線損傷相關的突變量遠低於平均水平,且缺乏體細胞驅動皮膚鱗癌的必要突變。而 HPV19 的表達水平卻很高,且序列特徵顯示,它已經整合在了人體的 DNA 序列中,存在高水平的致癌基因表達。所以鬧了半天,紫外線不是這例皮膚鱗癌的元兇,HPV 病毒感染纔是?
這就怪了,HPV 整合到人體序列中並促成癌變,是 α-HPV 中那些高危型 HPV 導致口咽癌、生殖器癌、肛門癌等黏膜惡性腫瘤的方式。HPV19 屬於 β-HPV,主要導致皮膚疣狀病變,既往的研究顯示 β-HPV 並不是維持皮膚鱗癌的必要條件[6],此前也從沒有研究報道過 β-HPV 能整合入人體的 DNA 中,導致和維持細胞的癌變[7]。爲什麼會出現這麼反常的情況?
或許患者的遺傳和免疫環境有特殊之處?
醫生於是對這位女士的外周血單核細胞進行了全外顯子組測序,結果發現了遺傳性的 ZAP70 基因突變。ZAP70 基因對應的是 T 細胞受體信號轉導所需的銜接蛋白,這個基因的致病性突變將導致 T 細胞無法正常行使功能。前文提到過,T 細胞是免疫系統的“巡邏兵”,不僅對於發現並清除 HPV 至關重要,在皮膚鱗癌免疫療法的起效中也是關鍵的角色。
難怪她身上 HPV 相關的疣狀病變日漸加重!
難怪免疫療法對她的皮膚鱗癌完全無效!
難怪一向“安分”的 β-HPV 變成了致癌的元兇!
基因檢測發現的 T 細胞缺陷,讓所有這些不尋常的現象都得到了解釋!
釜底抽薪的根治方案
明確了問題的根源,就找到了解決問題的方向:要修復 T 細胞的免疫缺陷纔行!
於是,醫生一邊聯合用藥抑制皮膚鱗癌的進展,一邊爲她進行了單倍體相合造血幹細胞移植。
植入的造血幹細胞爲她帶來了源源不斷的健康 T 細胞,免疫系統隨之喚醒了對 HPV 病毒的抵抗力。在此之後,包括皮膚鱗癌以及全身皮膚、黏膜的疣狀病變在內的所有 HPV 感染相關病變都得到了控制並逐漸穩定消退,至該病例寫成報告[8]時已隨訪三年,未見覆發。
這一次,這位女士終於走出了侵襲性皮膚鱗癌的重重夢魘,迎來了現代醫學爲她開拓的新生。
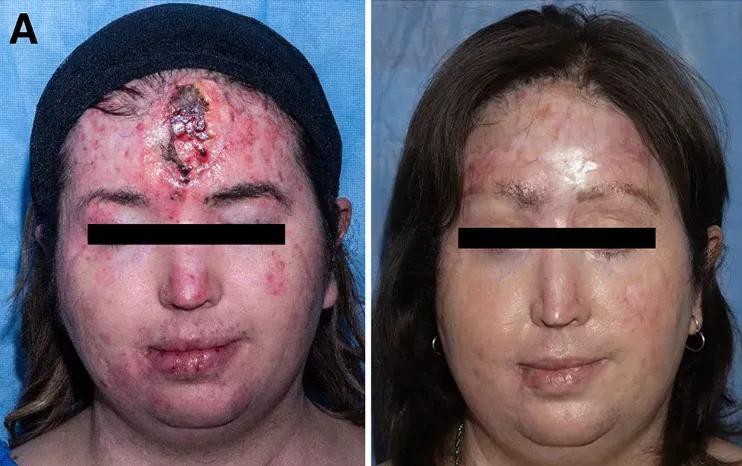
左圖爲皮膚鱗癌第二次復發,右圖爲造血幹細胞移植後 33 個月。圖片來自本案例文獻
讀完這個故事,你是否感覺自己就像跟着醫生的腳步,親歷了一場從困惑到明晰的疾病診療之旅?
回到開頭的疑問,爲什麼到醫院看病總要做很多檢查,醫生又是怎麼確定的治療方案。其實,某種程度上,醫生就像一個“偵探”,在做治療決策時,也像“偵探查案”一樣,不依賴“老經驗”,而是優先找“鐵證”。
現代醫學從不是“一刀切”的模板,而是以科學證據爲根基的“精準解謎”——在這個病例裏,指南推薦手術作爲皮膚鱗癌的一線方案,是基於多數患者的臨牀數據支撐,當常規手術反覆失效,醫生沒有盲目加碼治療,而是通過基因檢測、分子分析抽絲剝繭,每一步都依託嚴謹的醫學證據追溯病因,最終找到個體化根治方案。
這也恰恰是現代醫學的魅力所在:既遵循經過大規模研究驗證的標準路徑,又不忽視個體差異。那些看似複雜的檢查,其實都是爲了讓治療既不憑經驗臆斷,也不盲目試錯,用最靠譜的證據,爲每個患者找到最適合的答案。
參考文獻
[1] Stratigos AJ, Garbe C, Dessinioti C, et al. European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 1. epidemiology, diagnostics and prevention. Eur J Cancer. 2020;128:60-82. doi:10.1016/j.ejca.2020.01.007
[2] Stratigos AJ, Garbe C, Dessinioti C, et al. European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 2. Treatment. Eur J Cancer. 2020;128:83-102. doi:10.1016/j.ejca.2020.01.008
[3] Tschetter AJ, Campoli MR, Zitelli JA, Brodland DG. Long-term clinical outcomes of patients with invasive cutaneous squamous cell carcinoma treated with Mohs micrographic surgery: A 5-year, multicenter, prospective cohort study. J Am Acad Dermatol. 2020;82(1):139-148. doi:10.1016/j.jaad.2019.06.1303
[4] Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12(4):252-264. Published 2012 Mar 22. doi:10.1038/nrc3239
[5] Ladwa R, McLean L S, McGrath M, et al. The evolving role of Immune Checkpoint Inhibitors in Cutaneous Squamous Cell Carcinoma: across the disease spectrum[J]. EJC Skin Cancer, 2025: 100767.
[6] Arron ST, Ruby JG, Dybbro E, Ganem D, Derisi JL. Transcriptome sequencing demonstrates that human papillomavirus is not active in cutaneous squamous cell carcinoma. J Invest Dermatol. 2011;131(8):1745-1753. doi:10.1038/jid.2011.91
[7] Dimon MT, Wood HM, Rabbitts PH, Liao W, Cho RJ, Arron ST. No evidence for integrated viral DNA in the genome sequence of cutaneous squamous cell carcinoma. J Invest Dermatol. 2014;134(7):2055-2057. doi:10.1038/jid.2014.52
[8] Ye P, Bergerson JRE, Brownell I, et al. Resolution of Squamous-Cell Carcinoma by Restoring T-Cell Receptor Signaling. N Engl J Med. 2025;393(5):469-478. doi:10.1056/NEJMoa2502114
策劃製作
作者丨飛刀斷雨 醫學科普作者 科普作家協會會員
審覈丨徐敏 天津醫科大學代謝病醫院皮膚科副主任醫師 天津市醫學會皮膚性病學分會委員
策劃丨徐來
責編丨王夢如
審校丨徐來 張林林