我國科學家開闢幹細胞抗衰新路徑,該技術有望幫助延緩生理性衰老
衰老是生命不可避免的複雜生物學過程,涉及多組織器官的漸進性功能衰退。其中,機體各組織幹細胞的耗竭(數目逐漸減少,自我更新和分化能力持續下降)可導致組織再生修復能力減弱,與機體功能衰退密切相關。
如果把身體比作一個繁忙的城市,幹細胞就好像城市裏的建築工人。他們每天辛勤勞作,修復損傷,保持一切順利運行,並在需要時建造新結構。但隨着年齡的增長,“工人”越來越少,修復放緩,損壞積累,身體便開始衰老。
鑑於“幹細胞耗竭”與衰老之間的關係密切,科學家們曾在國際學術雜誌《細胞》上將其列爲“衰老的十四大標誌”之一。近年來,外源幹細胞移植作爲一種潛在的延緩衰老和疾病干預手段,也受到了廣泛關注。然而,幹細胞耗竭在衰老過程中究竟是誘因還是結果?外源性幹細胞移植能否有效延緩衰老?種種關鍵科學問題長期以來懸而未決。
深耕十餘年,致力於衰老幹預探索
爲攻克這些難題,研究團隊長期致力於衰老幹預的探索。研究發現,現有幹細胞療法存在侷限性:移植入體內的幹細胞存活率低,存留時間過短,幾乎沒有“一展身手”的機會。衰老微環境中高水平的氧化應激、慢性炎症、多種代謝毒素等顯著降低了移植細胞的存留,成爲干擾幹細胞發揮作用的一大障礙。
從 2011 年開始至今,團隊始終秉持着“改造細胞對抗衰老”的研究主線,逐步攻克了幹細胞療法中的關鍵瓶頸。
2011 年,團隊藉助先進的基因編輯工具(HDAdV 病毒載體),首次在人類幹細胞中成功修復了導致早衰症的基因突變。這項研究不僅糾正了細胞的病變特徵,更首次從科學角度證實:通過基因改造“重置”細胞的衰老時鐘是可能的,這爲未來“長壽細胞”的建立打下了基礎。
歷經十餘年的不懈探索,團隊系統解碼了細胞衰老調控通路,通過HDAdV介導的基因編輯技術,構建了抗衰型人間充質祖細胞(SRC)技術體系。
SRC1.0 版本(2017):對抗氧化樞紐基因 NRF2 實施 A245G 精準編輯,促進 NRF2 轉錄因子核滯留、提升其轉錄激活效能,就像給細胞裝上“抗氧化增強器”,顯著提升了細胞清除有害物質的能力,最終建立具備代謝高活力與基因組高穩態的增強型細胞;
SRC2.0版本(2019):對長壽基因 FOXO3 進行雙位點改造(T757G/T943G),改變了其被磷酸化和在胞質中被降解的命運。FOXO3 得以持續待在細胞核內,啓動一系列抗衰老、抗壓力、抑制惡性轉化的防禦基因,最終成功賦予該細胞可移植的增強型功能特性。
近期,團隊通過創新性研究,成功開發出新一代具有多重抗衰老特性的工程化人類抗衰型間充質祖細胞(SRC),在靈長類動物實驗中證實了其顯著延緩多器官衰老的效果,並且輸注SRC後的動物神經元年輕化程度相當於人類“年輕 7 歲”,爲人類衰老幹預開闢了全新的細胞治療路徑。相關成果發佈在《細胞》(Cell)上。
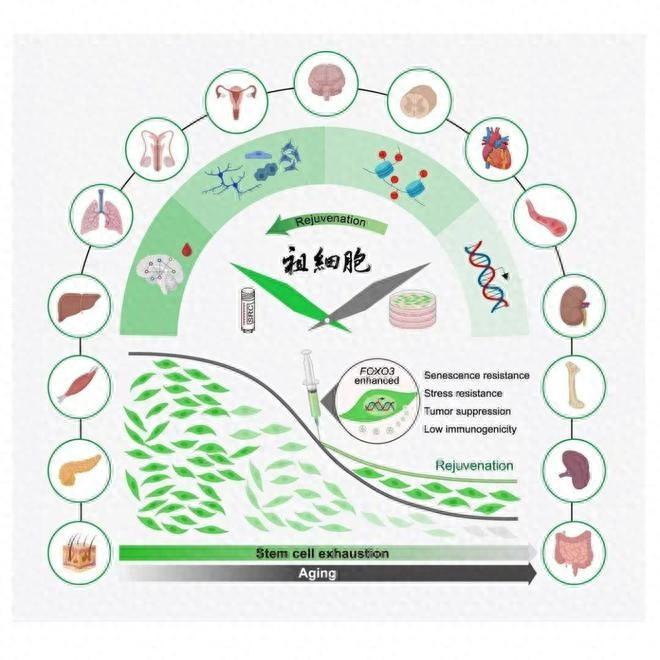
抗衰型人間充質祖細胞(SRC)延緩靈長類多器官衰老示意圖(圖片來源:參考文獻[1])
SRC2.0 版本:抗衰老效果顯著
FOXO3 是公認的人類長壽因子,它作爲轉錄因子可啓動一系列抗衰老、抗應激、抗惡性轉化相關基因。當研究人員通過基因編輯手段將 FOXO3 的兩個磷酸化位點進行突變,改變了其被運出細胞核和被降解的命運。轉而持續激活下游基因轉錄。抗衰表型分析數據顯示,FOXO3 增強型 SRC表現出以下突出優勢:
1.具有顯著的延緩衰老效應;
2.對環境壓力錶現出極強的耐受性;
3.展現出理想的安全性特徵。
該細胞羣體不僅能有效應對衰老相關的惡劣微環境,同時成功避免了傳統細胞移植可能引發的腫瘤形成風險。
爲了驗證 SRC 移植是否能夠延緩靈長類衰老,促進其臨牀應用和推廣,團隊設計了新一輪實驗。
在最新的實驗中,以生理狀態相當於人類 60-70 歲健康老年人的老年食蟹猴作爲實驗對象,開展了爲期 44 周的 SRC 細胞干預研究。以“每公斤體重 200 萬個”的劑量,每兩週通過靜脈輸注一次的方式,將SRC輸入到食蟹猴體內,用以評估其抗衰老效果。

實驗對象食蟹猴(圖片來源:參考文獻[1])
首先,研究人員監測了與安全性相關的 40 多項指標,包括體重、體溫、血糖、血常規、血生化等。結果顯示,向靈長類動物多次靜脈注射 SRC 沒有引起與細胞移植相關的不良反應,例如體重減輕、發熱、免疫系統過度活化、肝腎功能異常等。此外,通過全面的病理學檢查排除了致瘤風險。
通過系統評估,發現 SRC 移植顯著改善了老年動物的認知功能,特別是提升了短時記憶能力,同時有效緩解了與年齡相關的大腦皮層萎縮、牙槽骨退化和骨質疏鬆等退行性改變。更爲重要的是,通過對 10 大生理系統的 61 種組織樣本進行系統分析,證實 SRC 移植能夠顯著延緩多器官衰老進程,重建機體內環境穩態。
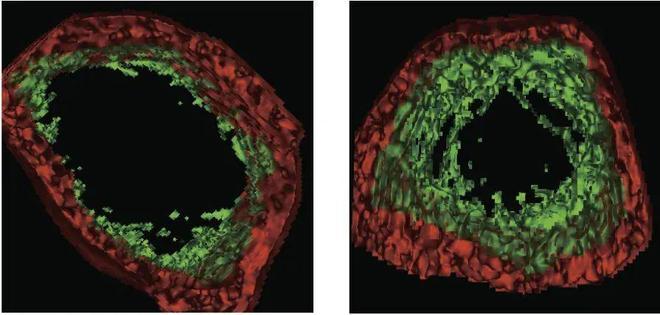
SRC治療有效逆轉老年猴骨質疏鬆,對照組(左);SRC處理組(右)(圖片來源:參考文獻[1])
通過基因檢測發現,這些經過 SRC 治療的衰老組織,有一半以上都出現了“逆生長”現象——那些本該隨着年齡增長而異常活躍的衰老基因,重新恢復了年輕時的狀態。基於機器學習的“衰老時鐘”分析證實,未成熟神經元生物學年齡被逆轉 6 歲至 7 歲,卵母細胞的生物學年齡被逆轉 5 歲。
那麼,僅僅通過向血液中注入 SRC 細胞,是如何逆轉多組織器官衰老的?緊接着,研究團隊進一步探究了其具體的作用機制。結果表明,SRC 釋放的外泌體發揮了重要作用。外泌體好像“微型快遞箱”,這些納米級小包裹像青春郵差,把“減齡信號”送到全身:它們不僅幫細胞打掃老化垃圾、減少身體裏的“小火苗”炎症,還能像修理工一樣維護 DNA 和基因穩定,讓細胞保持年輕、健康的狀態。
科學意義與價值
這項研究實現了多器官協同抗衰,突破了傳統“單一疾病靶向治療”的侷限,有力證明了“設計生命對抗衰老”的可行性,同時具有多重科學價值。
在基礎理論層面,該研究構建並驗證了幹細胞移植可減緩靈長類衰老的理論框架,解決了該領域長期存在的理論爭議。同時,研究深入解析了其潛在作用機制及核心通路,爲後續的靶向干預提供了理論基礎。
在技術創新方面,通過基因改造賦予幹細胞響應衰老應激的能力,開發出可規模化生產的通用型細胞移植材料。建立了適用於靈長類移植的功能增強型幹細胞的製備範式,拓展了細胞治療的研發維度。
在應用轉化層面,鑑於非人靈長類動物與人類在生理上的高度相似性,這一成果爲人類異體幹細胞移植的臨牀轉化奠定了基礎。作爲首個在靈長類模型中安全有效的細胞抗衰臨牀前方案,該研究爲未來人類衰老幹預的臨牀試驗提供了關鍵參考與技術框架。
展望未來:
從“被動應對”邁向“提前干預衰老”
未來,這項技術要真正走向臨牀應用,仍有許多科學問題需要進一步探索。
首先,在生產環節,需要開發和完善 SRC 的臨牀級製備工藝以及標準化質控手段。
其次,還需深入解析 SRC 在體內的行爲模式——比如它們更喜歡在哪些器官停留?能工作多久?會不會被免疫系統“誤傷”?
在實際使用方面,就像喫藥需要講究劑量和療程一樣,研究人員需要找到最適合的細胞用量、注射頻率和治療時機。更值得期待的是,未來在保證“通用性”的同時,或許還可以根據個體差異因素(性別、遺傳、病理生理異質性),實現“私人定製”抗衰老方案,以優化治療效果。
這項技術的應用前景非常廣闊。除了有望幫助健康人羣延緩生理性衰老,它還爲神經退行性疾病、心血管疾病、骨關節炎和卵巢早衰等衰老相關疾病提供了潛在的細胞藥物。
可以說,SRC 技術有望推動衰老幹預從“被動應對”邁向“提前干預衰老”的主動健康管理新時代。
參考文獻
[1]Lei, Jinghui, et al. “Senescence-Resistant Human Mesenchymal Progenitor Cells Counter Aging in Primates.”Cell, 13 June 2025, doi:10.1016/j.cell.2025.05.021.
策劃製作
出品丨科普中國
監製丨中國科普博覽
責編丨張一諾
審校丨徐來、張林林