揭祕現實中的“冰系魔法師”,原來如此神奇......
在影視作品中,冰系魔法師們往往能瞬間冰封萬物,這種極具衝擊力的畫面令人印象深刻,如此將物質在極低溫下凍結的設定,雖充滿藝術想象,卻與現實生活中科學家們使用的冷凍電鏡技術(Cryo-Electron Microscopy, Cryo-EM)在覈心理念方面存在微妙的聯繫。
冷凍電鏡的核心奧祕正在於它可利用極低的溫度(約-185 攝氏度甚至更低)將生物大分子(如蛋白質、病毒等)“定格”在電鏡之下,從而捕捉其本真狀態,爲解析生命活動的奧祕提供了可能。憑藉這項革命性技術,三位科學家榮膺 2017 年諾貝爾化學獎,諾獎委員會盛讚其“將生物化學帶入了新的紀元”。

2017 年諾貝爾化學獎獲得者:雅克·杜博歇、阿希姆·弗蘭克、理查德·亨德森(圖片來源:諾貝爾獎官方網站)
那麼,這種技術爲何需要如此極端的低溫?這“冰封”之力的背後到底蘊藏着怎樣的科學原理?今天,我們一起走進這個“冰封的微觀世界”,共同探尋它的奧祕。
爲什麼要“冷凍”生物大分子?
要理解冷凍電鏡中“冷”的關鍵意義,首先要明確它要克服的核心挑戰:要觀察天然、完整且具有生命活性的生物大分子(如蛋白質、病毒等),必須在接近生理狀態的水溶液環境下進行。
然而,傳統透射電鏡的工作環境與維持生物大分子天然狀態的需求存在根本性衝突,主要體現在三個方面:
1.高真空導致水環境喪失
透射電鏡樣本必須維持在高真空環境中,這是因爲透射電鏡是利用電子束作爲光源的,而電子束只有在真空中才能保持穩定、直線地傳播。如果環境中存在空氣,空氣中氣體分子就會與電子束髮生碰撞,使電子束偏離原來的傳播方向,導致成像模糊,無法準確反映樣品的微觀結構。
在此條件下,樣本中維持生物分子天然結構所必需的水溶液會被瞬間抽乾,如同水滴落在熾熱的鐵板上。這將導致高度依賴水合層穩定的蛋白質結構嚴重變形甚至塌陷,其天然構象徹底喪失。
2.高能電子束造成輻射損傷
在真空環境中,失去水層保護的生物大分子直接暴露於透射電鏡的高能電子束下。這些電子束會如同密集的子彈,直接轟擊樣品中裸露的蛋白質,造成嚴重的結構損傷,最終獲得的圖像也與其在生物體內的真實狀態相去甚遠;
3.布朗運動導致成像模糊
在傳統透射電鏡的室溫環境下,生物大分子持續進行着劇烈且隨機的布朗運動。在這種高速運動下拍下的電鏡成像,就如同用慢快門拍攝快速移動的物體——結果必然是圖像模糊、出現重影,無法獲得清晰、穩定的結構信息。
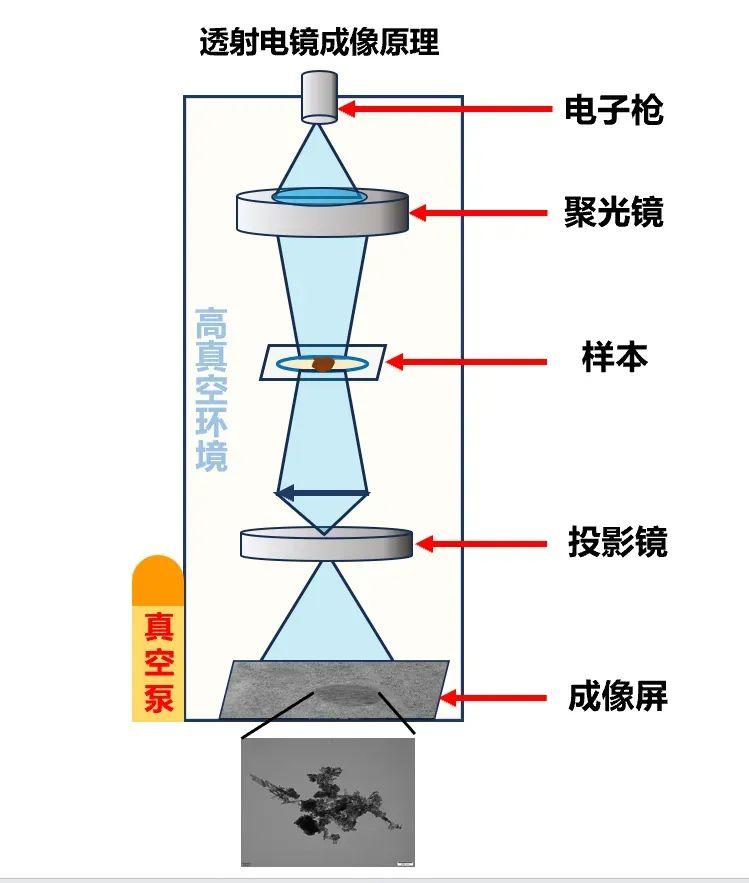
傳統透射電鏡的成像原理(圖片來源:作者)
冷凍電鏡則通過革命性的技術手段,巧妙地解決了上述矛盾:它能將含水的生物大分子溶液樣本,在毫秒級時間尺度內,急速冷凍至液氮溫度(約-196 攝氏度)甚至更低。這種超快速冷凍可使溶液中的水分子來不及形成破壞性的冰晶,而是形成一種非晶態的固態冰(即“玻璃態冰”)。
玻璃態冰如同完美的“分子鑄模”,可以將包裹在其中的生物大分子瞬間“凍結”在其天然的溶液構象中,在幫助維持其形貌結構的同時,超低溫的環境也限制了蛋白質的分子的熱運動。在冷凍電鏡的腔體中,這種狀態下的生物樣品在精密調控的低劑量電子束照射下進行成像,最大程度地保留了生物樣品的原始結構。
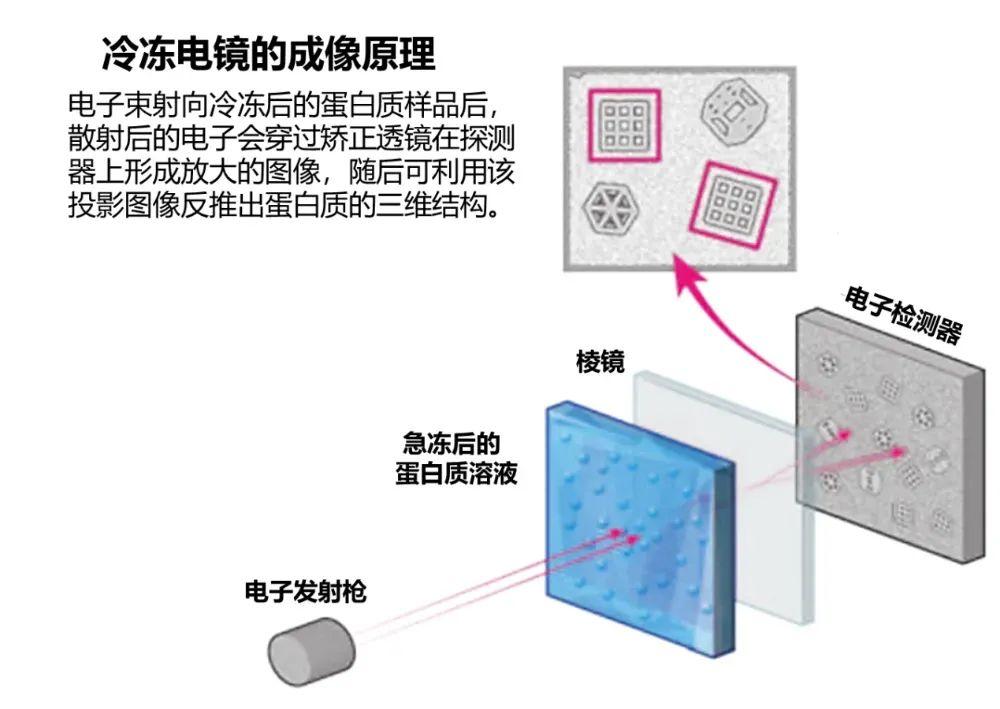
冷凍電鏡的成像原理(圖片來源:參考文獻[6])
到底要有多“冷”?怎麼能做到這麼冷?
理解了爲什麼要“冷凍”生物大分子,現在,我們來接着探究“冷凍”所需的具體溫度。冷凍電鏡工作時的核心低溫來源於使用液氮(-196 攝氏度/77 開爾文)或液氦(零下 269 攝氏度/4 開爾文)作爲系統中的製冷劑。樣本在投入液乙烷快速冷凍後,會被轉移到特殊的觀察冷臺上。這個冷臺被浸泡在液氮或液氦中冷卻,在整個電鏡觀察過程中,樣本溫度始終維持在接近液氮/氦溫度的極寒環境,即大約-180 攝氏度到-269 攝氏度。
這種程度到底有多“冷”?可以通過兩個對比直觀感受一下:
1.196 攝氏度(液氮溫度)
比地球上南極洲的最冷記錄(約-89 攝氏度)還要低 100 多攝氏度!在這個溫度下,整個空氣中的氧氣、氮氣都會凝結成液體。
2.269攝氏度(液氦溫度)
距離物理學上的絕對零度(-273.15 攝氏度)僅差 4 度!這幾乎是常規情況下人類在實驗室能達到的最低溫度。想象一下,這是將樣本置於比太陽系邊緣冥王星表面(平均約-230 攝氏度)還要寒冷近 40 攝氏度的極寒環境,生命活動在此被近乎徹底“凍結”。
“冷凍”之後,
如何還原生物分子的三維結構?
然而,將含水樣本在不破壞其原始形貌的條件下凍到如此極寒的程度,還只是第一步。要獲得原子級分辨率(約 0.3 納米甚至更高)的清晰結構,還需要克服急凍狀態下,蛋白質分子取向隨機性的挑戰——樣本中成千上萬個相同的分子,被冷凍時是以隨機的姿態“躺”在冰層裏的,朝向四面八方,這將導致拍到的生物大分子圖像是蛋白質在隨機一個方向上的二維投影。

蛋白質分子在急凍後樣品中的隨機取向(圖片來源:參考文獻[7])
不過,而聰明的科學家們早已想到利用計算機強大的圖像處理算法和計算能力將二維的蛋白質分子投影還原爲三維的立體分子結構:
1.海量數據採集
對於同一樣本區域的圖像,電鏡自動採集數萬、數十萬甚至上百萬張不同角度的蛋白質顯微照片。
2.優選粒子圖像
計算機程序從這些海量模糊照片中自動識別、挑選出結構狀態較好的目標分子,獲得數十萬甚至上百萬個“單顆粒”圖像。
3.分類與對其
算法根據分子的不同朝向(隨機分佈的優勢在此體現),將這些單顆粒圖像按照相似的角度進行分類,並將同一類別的圖像進行精確的對齊疊加。
4.三維結構重構
基於類似 CT 掃描的電子斷層掃描技術,計算機利用不同角度的二維投影信息,通過傅里葉變換、迭代優化等複雜的數學計算,最終重構出生物大分子的高分辨率三維結構模型。傅里葉變換是指從多角度拍攝樣品的二維投影,經數學變換後各代表三維物體在不同“頻率空間”中的一個投影切片。將這些切片按角度拼合成完整的三維頻率圖,再通過逆變換還原出立體結構。
這個過程可以類比爲通過一個物體的三視圖(如前視圖、側視圖、俯視圖)來還原其立體結構。當然,蛋白質的三維結構遠比簡單幾何體複雜得多,需要整合其海量不同角度的二維投影圖片,通過深度反演推算才能實現蛋白質高分辨三維結構重建。
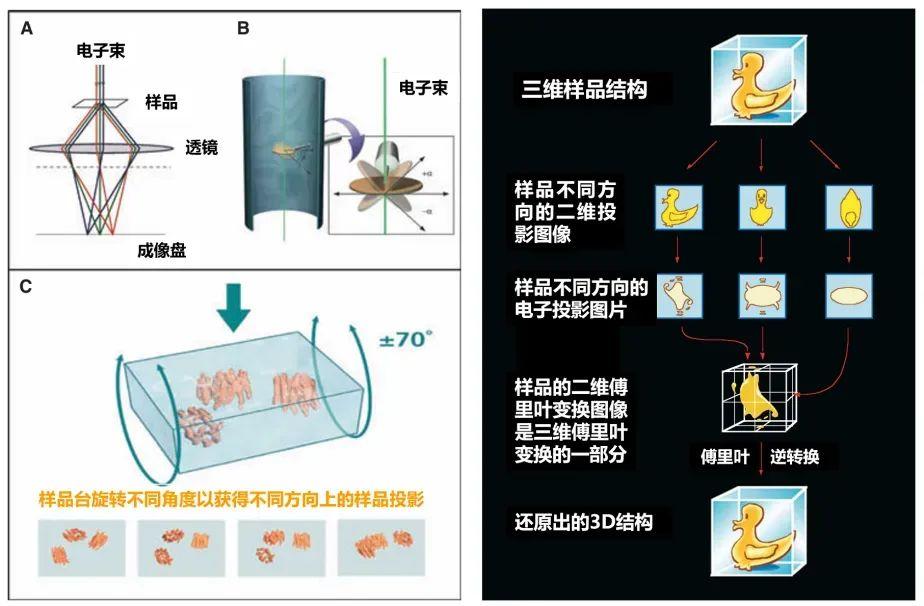
左:多角度掃描蛋白質結構投影;右:二維投影反推三維結構原理(圖片來源:參考文獻[7])
“冷凍”的終極意義:
凝固生命的瞬間,解碼自然的精妙
正是這種逼近宇宙極限的極寒,讓我們得以突破觀測瓶頸,將瞬息萬變、脆弱無比的生物大分子“凍結”在最接近天然活動的狀態,並以接近原子級的分辨率解析其複雜而精妙的三維結構。
從揭示核糖體合成蛋白質的機制,到解析新冠病毒表面刺突蛋白結構以加速疫苗研發,再到描繪神經受體傳遞信號的奧祕——冷凍電鏡的每一次“定格”與“成像”,都是人類向生命微觀世界最深處發起的一次叩問。它所展現的,不僅僅是人類對物理意義上絕對低溫的掌控和應用,更是科學家們發揮人類智慧突破認知疆界的非凡決心。這“冷”的表象之下,湧動着的,是對生命運行規律熾熱的探索渴望。
因此,當你再聽到下一個重要的蛋白質結構被成功解析時,不妨想想那接近絕對零度的極寒瞬間,那一刻凝固着生命律動中最美妙的一幀!
參考文獻
[1] 趙明潔,曹端方,章新政.基於冷凍電鏡無傾轉成像數據的新型蛋白質原位結構解析方法[J].生物化學與生物物理進展,2024,51(10):2418-2429.
[2] 劉霞.冷凍電鏡“看清”免疫調控蛋白結構[N].科技日報,2025-06-19(004).
[3] 楊梓,範瀟,王宏偉.應用單張冷凍電鏡顯微照片解析近原子分辨率的單顆粒三維重構[J].電子顯微學報,2025,44(01):91-105.
[4] 趙明潔,曹端方,章新政.基於冷凍電鏡無傾轉成像數據的新型蛋白質原位結構解析方法[J].生物化學與生物物理進展,2024,51(10):2418-2429.
[5] 莫家媚,張少鴻等.冷凍掃描電鏡制樣方法及其在含水樣品中的應用[J].電子顯微學報,2024,43(02):231-239.
[6] Callaway, E. The revolution will not be crystallized: a new method sweeps through structural biology. Nature 525, 172–174 (2015).
[7] Jacqueline L. S. Milne1, E. Cryo‐electron microscopy - a primer for the non‐microscopist[J]. The FEBS Journal, 2013, 280(1).
[8] Taylor K A, Glaeser R M. Electron microscopy of frozen hydrated biological specimens[J]. Journal of Ultrastructure Research, 1976, 55(3):448-456.
[9] Dubochet J, Lepault J, Freeman R, et al. Electron microscopy of frozen water and aqueous solutions[J]. Journal of Microscopy, 1982.
策劃製作
出品丨科普中國
作者丨周靖辰 中國科學技術大學
監製丨中國科普博覽
責編丨張一諾
審校丨徐來、張林林