這個諾獎遲到了30年!三位科學家揭示免疫系統如何避免“自相殘殺”



“他們的發現對於理解免疫系統運作機制,以及解釋爲何並非所有人都會罹患嚴重自身免疫疾病具有決定性意義。”

今天(10月6日),瑞典卡羅林斯卡醫學院宣佈,2025年諾貝爾生理學或醫學獎授予瑪麗・E・布倫科夫(Mary E. Brunkow)、弗雷德・拉姆斯德爾(Fred Ramsdell)和坂口志文(Shimon Sakaguchi)三名科學家,以表彰其在“外周免疫耐受”領域的發現。由此,布倫科夫也成爲歷史上第14位女性獲獎者。
外周免疫耐受究竟是什麼?它如何阻止免疫系統“自己人打自己人”?基礎研究的突破能爲癌症、自身免疫病等治療帶來哪些前景?記者就這些熱點問題採訪了相關領域專家。
免疫系統存在“維和部隊”
“並不意外!”接到記者電話,上海科技大學生命科學與技術學院研究員李揚揚直呼很振奮,“早在幾年前,科學界便已有呼聲,認爲這一領域的研究值得諾貝爾獎的認可。”
人體強大的免疫系統能夠保護我們免受成千上萬試圖入侵人體的病毒、細菌及其他微生物的侵襲。沒有一個正常運作的免疫系統,我們將難以生存。可免疫系統一旦缺乏調控,它也可能攻擊自身器官,而調節性T細胞正是免疫系統的“維和部隊”。
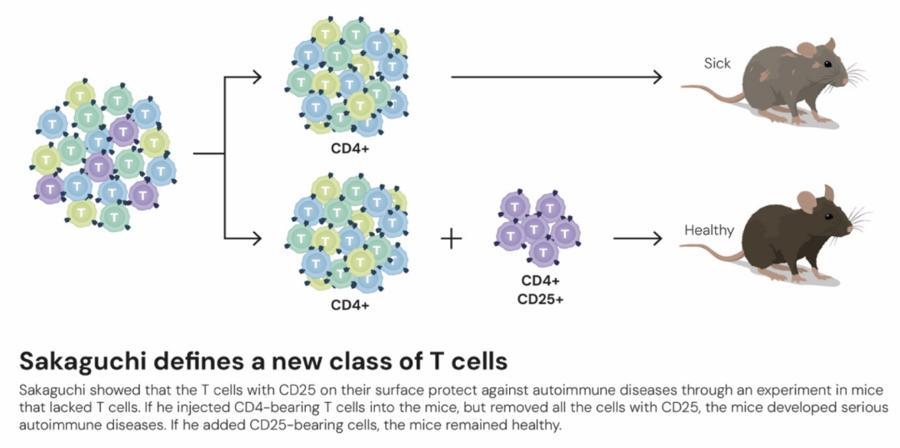
1995年,坂口志文做出一項關鍵發現。當時多數研究者認爲免疫耐受僅通過胸腺中有害免疫細胞的清除,即“中樞耐受”機制形成。而坂口志文卻證明免疫系統遠比這複雜得多,他發現了一種能預防自身免疫性疾病的調節性T細胞,這類細胞可以阻止免疫系統攻擊自身組織,從而維持免疫系統的平衡。
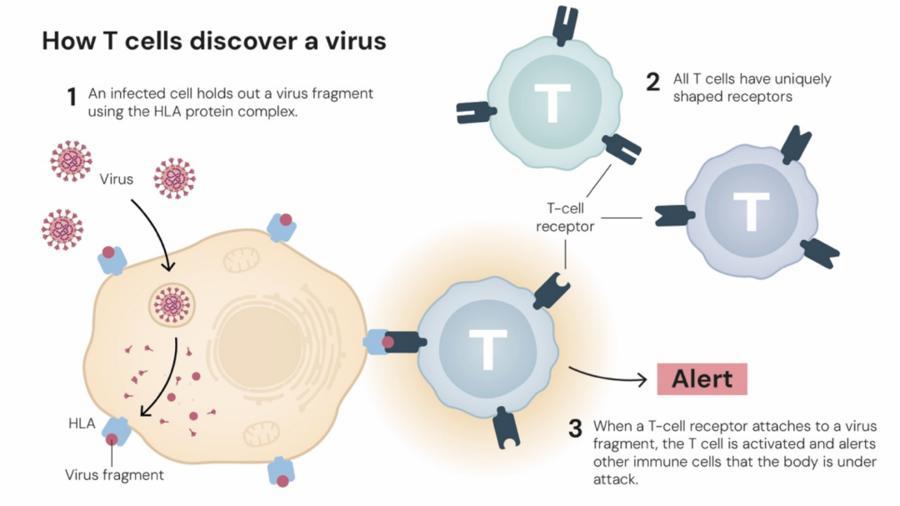
“就好像踩下免疫剎車一般,下調過度激活的免疫反應對我們身體同樣重要。”李揚揚說,而調節性T細胞發育離不開關鍵轉錄因子即Foxp3。
2001年,瑪麗・E・布倫科夫和弗雷德・拉姆斯德爾取得了另一項重要發現,解釋了特定小鼠品系爲何特別容易患自身免疫性疾病。他們發現,這些小鼠體內Scurfin基因發生了突變,也就是Foxp3基因。進一步研究發現,人類相應基因的突變同樣會導致嚴重的自身免疫性疾病——IPEX綜合症。患兒常於嬰兒期出現腹瀉、溼疹樣皮疹、1型糖尿病等多種自身免疫性問題。
兩年後,坂口志文和另兩名科學家發現,Foxp3基因控制着調節性T細胞發育和功能,負責監控其他免疫細胞,並確保人體免疫系統能夠耐受自身組織,爲調節性T細胞在外周免疫耐受領域的重要作用奠定了基礎。
沉寂多年的概念重新“復活”
事實上,與現在的外周免疫耐受研究熱不同,在科學界,有人稱這是一項“遲到了30年”的諾獎發現。
上海交通大學醫學院附屬第一人民醫院臨牀研究院執行副院長王宏林介紹,早在20世紀60至70年代,免疫學界就提出過抑制性T細胞的概念。但由於當時實驗技術和檢測方法相對落後,不同實驗室得出的研究結果常常相互矛盾,難以形成統一結論。到了 20世紀80年代初,抑制性T細胞的概念已幾乎被學界完全廢棄。直到1995年,坂口志文團隊發表關鍵性研究,才讓這一沉寂多年的概念重新“復活”。
“如果調節性T細胞的功能下降,對異常免疫反應的監控和抑制能力減弱,那麼自身反應性免疫細胞克隆就可能被激活,進而攻擊機體自身的器官和組織,最終導致自身免疫病。” 上海交通大學醫學院附屬瑞金醫院風溼免疫科主任醫師楊程德解釋說,基於這一機制,科學家們提出了一個思路:能否通過增強調節性T細胞的數量或功能來糾正失衡的免疫系統,從而治療自身免疫病?
“目前,圍繞這一思路的動物實驗已取得較大成功,但這些策略在人類身上的應用還處於臨牀前期階段。”楊程德同時提及,Foxp3作爲調節性T細胞的重要標誌分子,已成爲後續研究的核心靶點,許多針對自身免疫病的治療方案設計,都圍繞調控 Foxp3的表達或活性展開。
“坂口志文教授一直活躍在調節性T細胞研究領域,在國際學術會議中經常分享該領域的最新成果,大家對他的研究非常熟悉。”李揚揚告訴記者,他從研究生時期便紮根這一領域,隨着研究深入,學界對調節性T細胞的認知也在不斷拓展:除了大衆熟知的免疫抑制功能,近年來研究發現,調節性T細胞還具備多種“非經典功能”—— 例如在代謝調控方面,它通過影響脂肪細胞功能,參與調節機體能量代謝平衡;在組織修復方面,它可表達雙調蛋白等分泌因子促進受損組織的再生與癒合。
“當前我們團隊的研究重點,正是探索調節性T細胞在不同組織或疾病微環境中的功能差異。”李揚揚進一步解釋,比如在腫瘤微環境中,調節性T細胞憑藉其出色的免疫抑制功能,幫助腫瘤細胞“逃避免疫系統追殺”。
“我們想弄清楚,在不同的疾病微環境中,調節性T細胞是否會有不同的代謝特徵,通過靶向或改造調節性T細胞代謝從而更精準地調控疾病中的免疫剎車,爲疾病治療提供新的靶點和策略。”李揚揚說。
臨牀轉化仍面臨不少挑戰
可以說,三位科學家的研究不僅爲外周免疫耐受這一此前未被充分探明的領域搭建了核心理論框架,更以此爲支點,爲癌症、自身免疫疾病等重大疾病的治療突破提供了全新方向。同時,也爲提升器官移植手術成功率、降低術後排斥反應帶來了極具潛力的研究思路。

“在1型糖尿病領域,調節性T細胞的應用可追溯至2015年。之後的臨牀試驗,包括輸注體外擴增的自體多克隆調節性T細胞(自體多克隆擴增調節性T細胞),已證實了其安全性,但其有效性仍未確定。”上海交通大學醫學院附屬瑞金醫院內分泌代謝科主任醫師顧衛瓊介紹,最新的一項單劑量自體多克隆擴增調節性T細胞的2期臨牀隨機試驗顯示,其未能有效維持早發1型糖尿病患者體內的胰島β細胞功能,與體外研究結果不符,這爲未來自體多克隆擴增調節性T細胞在1型糖尿病中的廣泛應用帶來巨大挑戰。預測通過嵌合抗原受體調節性T細胞療法等工程化改造,有望增強其靶向性和治療效果,並在未來5年到10年實現個體化治療方案。
王宏林在接受採訪時也提到,調節性T細胞的臨牀轉化面臨不少挑戰。“人類疾病的病因學極其複雜,涉及基因與環境的交互作用。儘管Foxp3基因缺失、突變會引發小鼠自身免疫性疾病或人類嚴重自身免疫病IPEX,但人類大部分自身免疫性疾病發生髮展與Foxp3基因表達異常的明確關係仍需進一步臨牀驗證。
“多項基於調節性T細胞的療法正處於臨牀試驗階段,這是令人振奮的進展,但同時也有一系列關鍵問題亟待突破。”王宏林說,如何通過藥物分子在體內調控調節性T細胞的質量和數量如何確保回輸的調節性T細胞在體內穩定性、減少其異質性?如何避免調節性T細胞潛在的副作用?上述種種問題都需要科研人員在後續研究中持續探索、逐一攻克。