一文讀懂:細胞沒有意識,卻爲何能精準執行生命功能?
我們體內約有36萬億個細胞,從腦細胞到肝細胞、從血細胞到皮膚細胞,每一個都在各司其職、井井有條地工作。[1] 一個神經元從不會分泌胰島素,一個肝細胞也不會突然產生心跳節律。它們沒有大腦、不會思考、沒有意志,卻能精準地執行其“職責”。
這種精密分工的源頭可以追溯到發育的起點——從一顆受精卵開始,那些基因完全相同的細胞,竟能在短短几天內自動分化成器官組織、血液骨骼、神經網絡......而這種清晰的分工背後卻沒有一箇中央指揮系統,彷彿與生俱來。
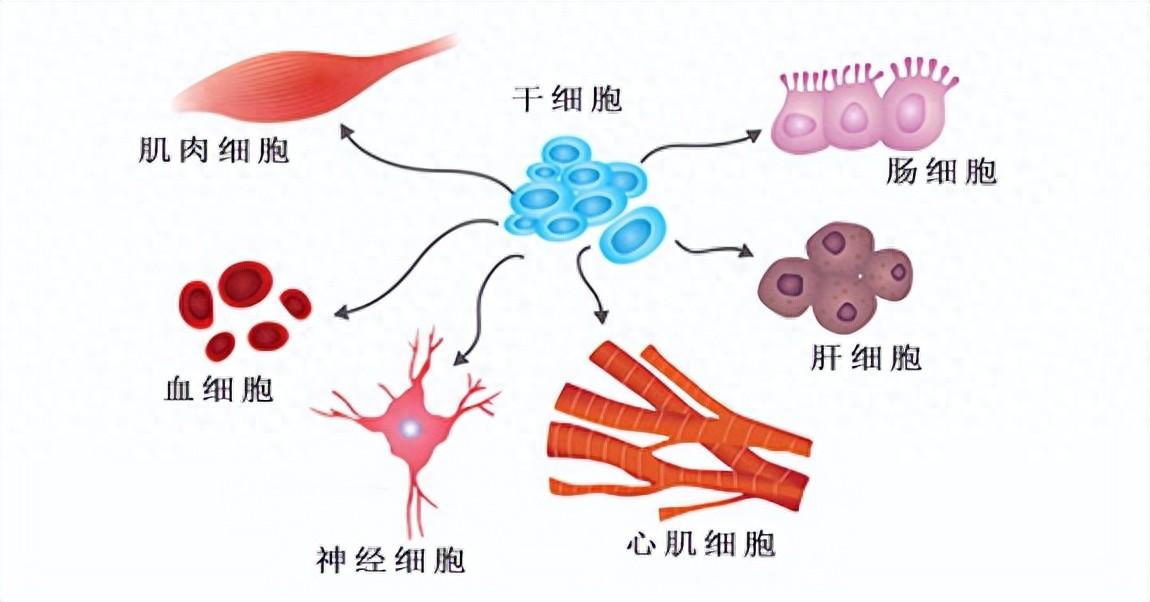
細胞分化示意圖
(圖片來源:Journal of the Royal Society Interface)
所以,細胞沒有意識,爲何能精準執行生命功能?這不是哲學問題,而是生物學問題。它背後牽涉的是:細胞的命運如何被決定?細胞又是如何“知道”該做什麼的?答案隱藏在現代發育生物學和分子生物學的核心原理之中。
同一套DNA,如何發展出萬千細胞“身份”?
我們身體的細胞幾乎都含有完全相同的DNA序列,這套“生命說明書”在受精的那一刻就已寫定。可爲什麼它們最終卻走上了不同的命運道路?
原因在於,並非所有“生命說明書”裏的內容都會在每一個細胞裏被讀出來使用,而決定哪部分基因被表達的,正是基因表達的調控系統。也就是說,多細胞生命的奧祕,不是不同細胞有不同的基因,而在於它們如何使用相同的基因組,通過選擇性表達產生不同的細胞類型。
對於真核細胞構成的個體(例如人類),其基因表達調控至少包含四個部分,層層遞進,精妙無比:
染色質結構與表觀遺傳修飾:DNA並不是裸露存在的,而是纏繞在組蛋白上形成染色質。緊密纏繞的區域(異染色質)通常關閉表達,而鬆散區域(常染色質)更容易被轉錄。表觀遺傳修飾是指是指在不改變DNA序列的前提下,通過可逆的化學修飾(如DNA甲基化、組蛋白修飾或RNA修飾)調控基因表達的一種遺傳調控機制。其中,組蛋白乙酰化會讓染色質結構變鬆,從而促進基因激活,而DNA的甲基化則往往意味着沉默表達。[2][3] 這就像同一本書,有些章節被封存,有些則可以隨時翻開,決定了基因可讀性。
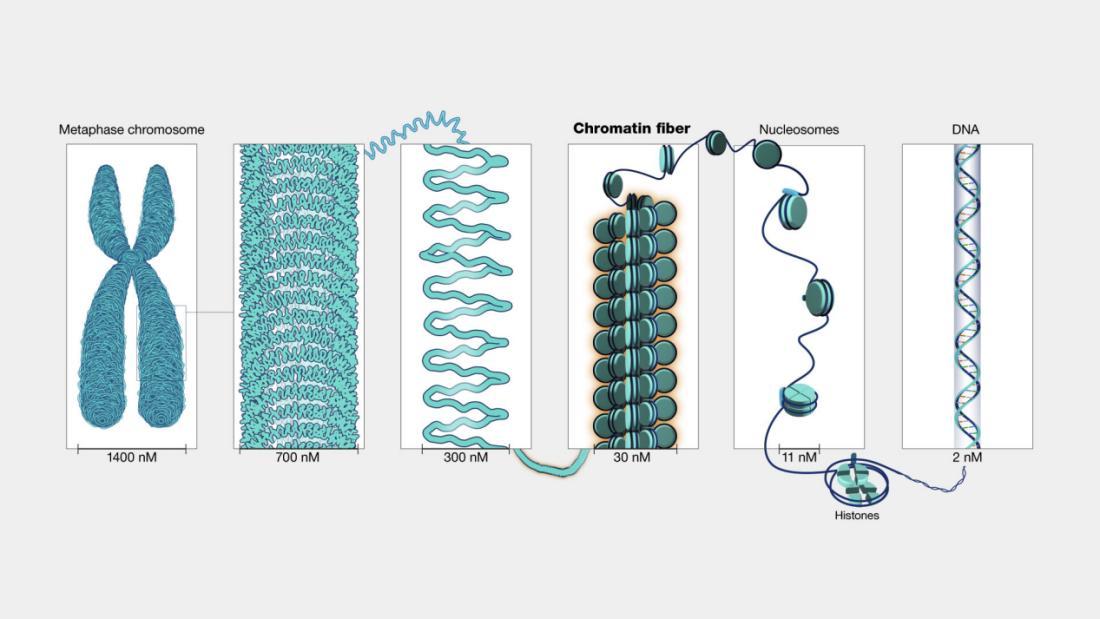
染色體結構尺度與組成
(圖片來源:NHGRI)
順式調控元件與轉錄因子:每個基因前都有啓動子作爲基本開關,而增強子與沉默子則像是遠程遙控器,負責增強或壓制表達強度。轉錄因子就是負責讀取這些模塊並下達命令的蛋白。
RNA水平的調控:即便一個基因被轉錄生成了mRNA,這條信息也可以被剪接成不同的版本,產生不同的蛋白質。此外,miRNA等非編碼RNA的參與,也能嚴密調控mRNA的穩定性、翻譯效率。
蛋白翻譯後的修飾與命運:蛋白質在覈糖體上完成翻譯後,並不會立刻具備完整的生物功能,而是需要經歷一系列被稱爲翻譯後修飾的過程來決定其最終“命運”。這些修飾包括如泛素化,即在特定位點連接泛素分子,通常標誌該蛋白將被細胞內的蛋白酶體系統識別並降解;磷酸化則是通過激酶將磷酸基團加到絲氨酸、蘇氨酸或酪氨酸殘基上,從而改變蛋白的構象、電荷狀態或與其他分子的結合能力,使其激活、抑制或重新定位;此外,許多蛋白還需通過構象摺疊、伴侶蛋白輔助、剪切加工等方式獲得成熟結構,才能行使特定功能。正是這些翻譯後修飾機制,使細胞能夠在不改變基因編碼的前提下,靈活調控蛋白功能、壽命和信號反應,是維持生理穩態與應答環境變化的重要調控手段。[4]
由此觀之,基因表達並非隨心所欲,而是像一道多級審批流程,需要層層審覈、批准、調控。
到底是什麼在決定每個細胞的命運?
雖然細胞擁有相同的DNA,但通過層層調控系統,它們只能打開屬於自己那部分章節。那麼,是哪一刻、在什麼條件下,一個細胞會不可逆地走向特定分化命運?這正是細胞命運決定機制的核心問題。
在胚胎髮育早期,所有細胞都是全能幹細胞,也就是什麼都能做的小胚胎。但這種全能性僅存在於受精後4—8細胞期(胚胎髮育的一個特定階段,指受精卵經過多次分裂後形成4個至8個細胞的時期)。進入囊胚期後,這些細胞就變爲多能幹細胞,開始進入命運的分岔路口,逐步鎖定自己的“職業路徑”。
這個命運分配過程,受到一系列高度保守且精妙的調控機制控制:
形態發生因子:這些是胚胎髮育過程中形成濃度梯度的關鍵信號分子。常見的有Shh、Wnt、BMP等多種信號,細胞通過感知這些信號的局部濃度差異,找到自己所處的位置,從而激活不同的命運程序。例如,Shh高濃度誘導神經管腹側發育出運動神經元;[5]Wnt的前後梯度決定胚體頭尾軸的分化;[6]BMP活躍區域趨向表皮,而其抑制區域則誘導神經組織的生成。
主調轉錄因子:細胞在接受信號刺激後,會啓動某些關鍵轉錄因子,它們能一錘定音地定義細胞身份。比如MyoD決定肌肉細胞[7]、Pax6主導眼睛發育[8],而PU.1和GATA1之間則決定免疫系統中不同細胞類型的分化[9]。這些關鍵因子就像是爲每一個細胞分配着未來的角色。
爲了確保細胞命運決定的不可逆性,大多數分化網絡中還存在互斥機制與正反饋系統。一旦某個路徑被激活,它就會增強自身表達,並壓制其他可能性,最終鎖定命運方向。
命運定了,如何執行?
一旦細胞的命運被鎖定,它便需要一整套內部操作系統來長期執行——這就是基因調控網絡(Gene Regulatory Network, GRN)。GRN不是單一開關,而是一個由轉錄因子、調控元件、靶基因等組成的複雜、動態運行的信息處理系統。不同的節點彼此激活、互相抑制,構成正負反饋,能夠對外部信號快速應答,又在內部維持穩態[10]。
例如,在肝細胞中,當血糖水平升高時,GRN會激活糖原合成基因來調節血糖,這正是其動態響應的體現。與此同時,肝細胞還依賴HNF1α、HNF4α、FoxA、C/EBPβ等多個肝特異性因子的互相激活,排斥非肝譜系基因,從而長期維持其肝細胞的特性。
細胞的命運可以被改寫嗎?
前文提到,細胞命運具有不可逆性。那是否意味着其命運一旦確定,就不可被更改?實則不然。2006年,日本科學家山中伸彌用四個轉錄因子,成功地將成年小鼠的皮膚細胞逆轉爲類似胚胎幹細胞的狀態,這一突破性成果被稱爲誘導多能幹細胞(iPSC)。這項研究發表於《Cell》雜誌[11],並促成他於2012年獲得諾貝爾獎。
iPSC的意義在於它首次向世界證明了:細胞命運走向並非單行道,基因調控網絡也並非不可破解。只要找到合適的控制點,就可以改寫細胞的命運——皮膚細胞可以變爲幹細胞,再重新分化成神經元、心肌細胞或胰島β細胞。這表明我們第一次擁有了改變自身細胞命運的強大能力。
擁有了這些能力之後,我們可以做到很多之前無法想象的事情,比如治療用iPSC技術和細胞重編程方法,我們開始嘗試治療之前被認爲需要終身用藥的糖尿病。
比如就在今年(2025年),殷浩教授團隊聯合中國科學院分子細胞科學卓越創新中心程新教授團隊,在國際學術期刊《細胞發現》(Cell Discovery)在線發表了最新研究成果。這是國際上首次利用幹細胞來源的自體再生胰島移植,成功治癒胰島功能嚴重受損糖尿病的病例報道。[12]
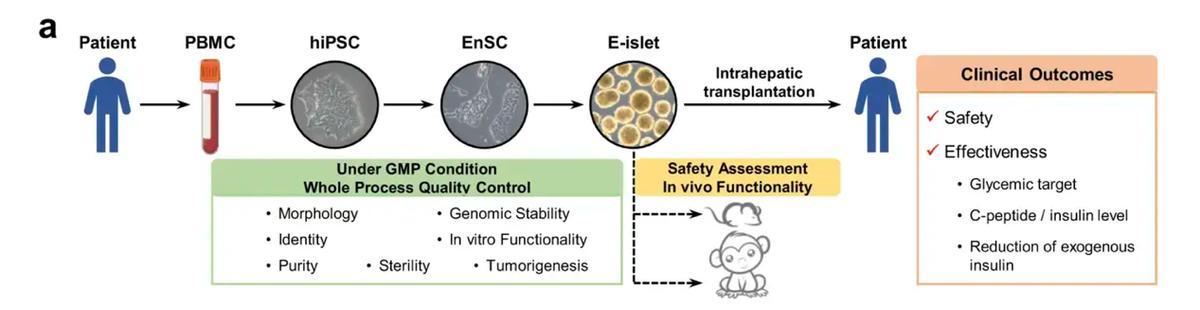
這個治療流程就是先抽取患者的外周血,分離出外周血單個核細胞(PBMC),作爲細胞重編程的起始材料;隨後通過引入特定轉錄因子,將PBMC誘導爲具有多向分化潛能的人誘導多能幹細胞(hiPSC);在特定誘導條件下,hiPSC被定向分化爲人類內胚層幹細胞(EnSC),作爲構建胰腺細胞系的重要中間前體;經胰腺譜系定向誘導後,EnSC進一步分化成熟爲具備葡萄糖響應性胰島素分泌功能的工程化胰島細胞團,也就是E-胰島(engineered islets, E-islet),可作爲功能性胰島替代物用於後續的體內移植與胰島功能重建。最後把這些具有功能性的E-胰島植入到患者的肝臟內,就使得患者再次擁有了自身分泌胰島素的功能。
這不得不說是再生醫學領域的一個重要的突破,爲一些糖尿病患者提供了新的治癒希望。
細胞沒有意識,如何構建會思考的我們?
看到這裏,最初的問題有了回答——單個細胞的確沒有意識,其命運由遺傳程序與環境信號協同調控決定。但新的問題也隨之產生,這些細胞無意識,那我們的意識又是從何而來的?
一個神經元沒有思想,它只是按照信號興奮和傳導。但當數百億神經元通過複雜拓撲連接與遞歸回路協同活動時,就出現了系統層面的湧現——即意識[13]。認知神經科學中的全球神經元工作空間(GNW)理論提出:只有當信息被“點燃”並在長程迴路中廣泛廣播時,才進入可報告的意識狀態[14]。
這就是複雜系統科學中所說的“湧現”:單個水分子不具備溼的屬性,但大量水分子聚在一起就能表現出溼的感覺;單隻螞蟻無法完成複雜工作,但蟻羣可以協調調配資源、完成驚人的結構建設。同樣地,細胞本身沒有意識,但它們的集合最終湧現出具有思考能力的我們。
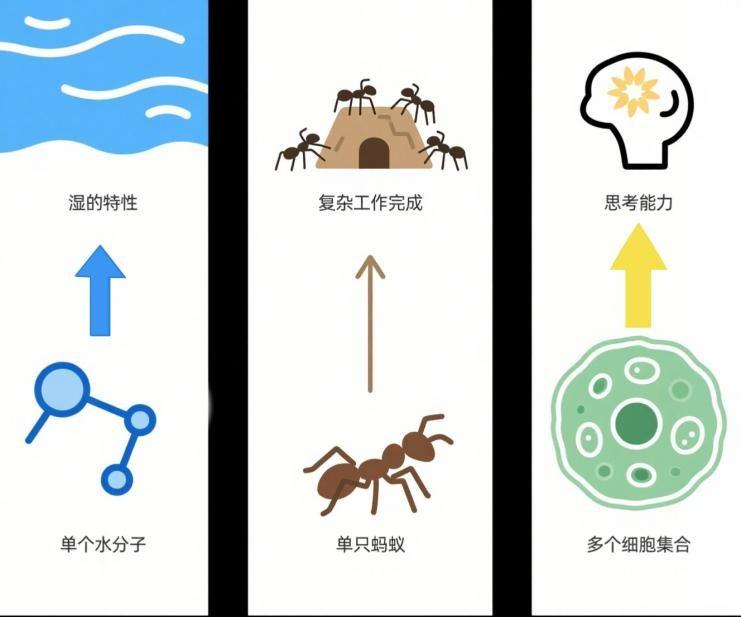
“湧現”的概念
(圖片來源:作者使用AI生成)
最近幾年,國內外各大生成式大語言模型十分火熱,它們也是經歷了類似的過程,才能具備一定能力。我們發現,從小模型到大模型,當模型突破某個規模時,它的語言理解能力、生成能力、邏輯推理能力有了極大幅度的非線性提升,這也被認爲是AI智慧的“湧現”[15]。
意識作爲一種複雜系統的“湧現”現象,其特點在於無法簡單地還原爲構成部分的屬性,而是系統整體協同作用的結果,通常伴隨着全新的、不可預測的行爲和能力。
從認知神經科學角度看,意識的產生需要大腦以高度複雜的結構進行信息整合。這包括多個腦區間的信息同步、整合記憶重構與未來預測的時序處理迴路、反饋與前饋機制之間的聯動以及足夠高的信號通量來支撐持續的神經活動。這些都是神經網絡層級才能具備的功能,遠非單一細胞能承載。
所以,細胞之所以沒有意識,是因爲它沒有能產生意識的結構系統;但它們通過各自的程序化行爲,最終組成了一個個有意識、會思考的人類個體。細胞無法自我理解,但它們依靠集體運作,賦予了我們認識自我的能力。而對這種協作機制的深入理解,正不斷推動着我們在再生醫學、疾病治療乃至人工智能等前沿領域不斷突破。
參考文獻:
[1] I.A. Hatton, E.D. Galbraith, N.S.C. Merleau, T.P. Miettinen, B.M. Smith, & J.A. Shander, The human cell count and size distribution, Proc. Natl. Acad. Sci. U.S.A. 120 (39) e2303077120, https://doi.org/10.1073/pnas.2303077120 (2023).
[2] Bird A. DNA methylation patterns and epigenetic memory. Genes Dev. 2002 Jan 1;16(1):6-21. doi: 10.1101/gad.947102. PMID: 11782440.
[3] Shogren-Knaak M, Ishii H, Sun JM, Pazin MJ, Davie JR, Peterson CL. Histone H4-K16 acetylation controls chromatin structure and protein interactions. Science. 2006 Feb 10;311(5762):844-7. doi: 10.1126/science.1124000. PMID: 16469925.
[4] Ciechanover, A. Intracellular protein degradation: from a vague idea thru the lysosome and the ubiquitin–proteasome system and onto human diseases and drug targeting. Cell Death Differ 12, 1178–1190 (2005). https://doi.org/10.1038/sj.cdd.4401692
[5] Yuichi Nishi, Xiaoxiao Zhang, Jieun Jeong, Kevin A. Peterson, Anastasia Vedenko, Martha L. Bulyk, Winston A. Hide, Andrew P. McMahon; A direct fate exclusion mechanism by Sonic hedgehog-regulated transcriptional repressors. Development 1 October 2015; 142 (19): 3286–3293. doi: https://doi.org/10.1242/dev.124636
[6] Yamaguchi TP. Heads or tails: Wnts and anterior-posterior patterning. Curr Biol. 2001 Sep 4;11(17):R713-24. doi: 10.1016/s0960-9822(01)00417-1. PMID: 11553348.
[7] Davis RL, Weintraub H, Lassar AB. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell. 1987 Dec 24;51(6):987-1000. doi: 10.1016/0092-8674(87)90585-x. PMID: 3690668.
[8] Gehring WJ. The master control gene for morphogenesis and evolution of the eye. Genes Cells. 1996 Jan;1(1):11-5. doi: 10.1046/j.1365-2443.1996.11011.x. PMID: 9078363.
[9] Zhang P, Zhang X, Iwama A, Yu C, Smith KA, Mueller BU, Narravula S, Torbett BE, Orkin SH, Tenen DG. PU.1 inhibits GATA-1 function and erythroid differentiation by blocking GATA-1 DNA binding. Blood. 2000 Oct 15;96(8):2641-8. PMID: 11023493.
[10] E.H. Davidson, & M.S. Levine, Properties of developmental gene regulatory networks, Proc. Natl. Acad. Sci. U.S.A. 105 (51) 20063-20066, https://doi.org/10.1073/pnas.0806007105 (2008).
[11] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006 Aug 25;126(4):663-76. doi: 10.1016/j.cell.2006.07.024. Epub 2006 Aug 10. PMID: 16904174.
[12] Wu, J., Li, T., Guo, M. et al. Treating a type 2 diabetic patient with impaired pancreatic islet function by personalized endoderm stem cell-derived islet tissue. Cell Discov 10, 45 (2024). https://doi.org/10.1038/s41421-024-00662-3
[14] Mashour GA et al. Conscious processing and the GNW hypothesis. Nat Rev Neurosci. 2020;21:751-764.
[15] Wei J et al. Emergent Abilities of Large Language Models. arXiv:2206.07682 (2022).
出品:科普中國
作者:冷哲(科普創作者)
監製:中國科普博覽